
科目: 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 过滤时,玻璃棒与三层滤纸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 硫酸、CuSO4·5H2O、苛性钾 B. 硫酸、空气、纯碱
C. 氧化铁、胆矾、熟石灰 D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液。将25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定到KMnO4不再褪色为止。
试回答:
(1)实验中不考虑铁架台等夹持仪器外,不需要的仪器有(填序号) ,还缺少的仪器有(填名称)_ 。
A托盘天平(带砝码,镊子) B滴定管 C 100mL容量瓶 D烧杯
e.漏斗 f.锥形瓶 g.玻璃棒 h.烧瓶
(2)实验中,标准液KMnO4溶液应装在______________式滴定管中。
(3)若在滴定前没有用amol·L-1的KMnO4溶液对滴定管进行润洗,则所测得的x值会___________(偏大、偏小、无影响)。
(4)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为__________mol·L-1,由此可计算x的值是____________。
(5)写出酸性高锰酸钾溶液滴定草酸溶液过程中反应的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____ 。

(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是 容器,都达到平衡状态时,NH3的质量分数最高的是 容器(填甲、乙、丙)。
下图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10 mol/L,c(H2) = 0.26 mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。

Ⅰ该反应实验②平衡时H2的转化率为 。
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 。
Ⅲ计算实验③的平衡常数为___________________。
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
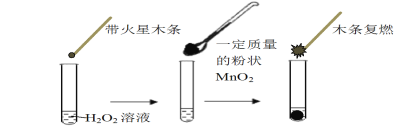
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式 。
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50 mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
MnO2的质量/g | 0.1 | 0.2 | 0.4 |
40s末O2体积/mL | 49 | 61 | 86 |
由此得出的结论是 。
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10 mL 5% H2O2 ) :
试管 | Ⅰ | Ⅱ | Ⅲ |
滴加试剂 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是 ,实验Ⅲ的目的是 。
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
一种工业合成氨的简易流程图如下:
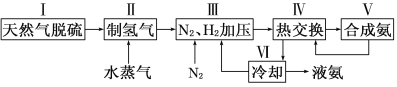
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着人们生活节奏的加快,方便的小包装食品已被广泛接受,为了防止副食品氧化变质,延长食品的保质期,在包装袋中常放入抗氧化物质.下列不属于抗氧化物质的是( )
A.生石灰
B.亚硫酸钠(Na2SO3)
C.铁粉
D.硫酸亚铁(FeSO4)
查看答案和解析>>
科目: 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线这五项中的( )
A.②④
B.③⑤
C.①②④
D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com