
科目: 来源: 题型:
【题目】2SO2(g) + O2(g)![]() 2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
2SO3(g) ΔH = a kJ·mol-1,反应能量变化如图所示。下列说法中,不正确的是
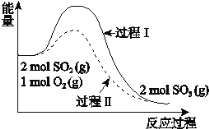
A.a<0
B.过程II可能使用了催化剂
C.使用催化剂可以提高SO2的平衡转化率
D.反应物断键吸收能量之和小于生成物成键释放能量之和
查看答案和解析>>
科目: 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)Al(NO3)3是制备钠硫电池部件的原料之一。由于Al(NO3)3容易吸收环境中的水分,因此需要对其进行定量分析。具体步骤如图所示:

①加入过量氨水后发生反应的离子方程式为:___________________________。
②操作b为:________________。
③Al(NO3)3待测液中,c(Al3+)=___________ mol/L(用含m、V的代数式表示)。
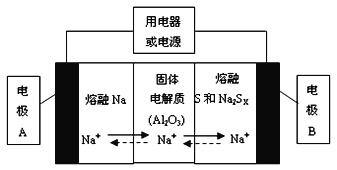
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050、 |
沸点/℃ | 892 | 444.6 | 2980 |
①根据上右表数据,请你判断该电池工作的适宜应控制在____________(填字母)范围内。
A.100℃以下 B.100~300℃ C.300~350℃ D.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
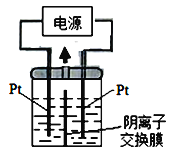
(3)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:________________;试分析左侧溶液蓝色逐渐变浅的可能原因是:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)![]() CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
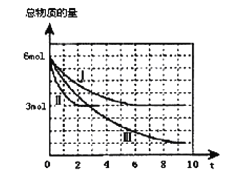
(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)下列说法正确的是( )

A. 由Q与Y形成的化合物中只存在离子键 B. Z与X之间形成的化合物具有还原性
C. 由X、Y、Z三种元素形成的化合物,一定是共价化合物 D. Y与W形成的化合物中,Y显负价
查看答案和解析>>
科目: 来源: 题型:
【题目】为了证明化学反应有一定的限度,进行了如下探究活动:
步骤1:取8mL0.1![]() 的KI溶液于试管,滴加0.1
的KI溶液于试管,滴加0.1![]() 的FeCl3溶液5~6滴,振荡;
的FeCl3溶液5~6滴,振荡;
请写出步骤1中发生的离子反应方程式:_________________
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.1![]() 的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
的KSCN溶液5~6滴,振荡,未见溶液呈血红色。
探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+完全转化为Fe2+,溶液无Fe3+
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与![]() 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:在试管A加入少量乙醚,充分振荡,静置 | _________________ | ________________ |
实验2:__________________________ __________________________________ | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来验证元素周期律.
用过氧化氢的水溶液和二氧化锰制备氧气,并将其通入到氢硫酸(H2S的水溶液)中.

(1)过氧化氢的电子式:_______________;
(2)从图1中选择氧气的制备装置______,反应前需要的操作是:________________;
(3)该实验如何证明O的非金属性强于S(用化学方程式表示)_____________;
(4)你认为能证明Cl的非金属性强于S的是___________
a.S在常温下为固体而Cl2为气体 b.H2S不如HCl稳定
c.H2SO3的酸性弱于HClO3 d.S与H2化合不如Cl2与H2化合剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com