
科目: 来源: 题型:
【题目】某温度下,将浓度都是0.1mol·L-1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol·L-1、c(Y2)=0.08mol·L-1、c(Z)=0.04mol·L-1,则该反应的反应式是
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A. 对2HI(g)![]() H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深
B. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动[
C. 合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施
D. 在溴水中存在如下平衡:Br2(g)+H2O(l)![]() HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅]
查看答案和解析>>
科目: 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
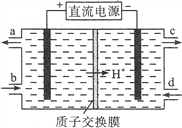
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,科学家在海洋中发现了一种冰状物质﹣﹣可燃冰,其有效成分为甲烷.下列说法正确的是( )
①甲烷属于烃类 ②在相同条件下甲烷的密度大于空气
③甲烷难溶于水 ④可燃冰是一种极具潜力的能源.
A.①②③
B.②③④
C.①③④
D.①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列观点正确的是( )
A.催化剂是影响化学反应速率的主要因素
B.化学反应的反应热与反应途径无关
C.增大压强一定能增大化学反应速率
D.反应物分子间发生碰撞即可发生化学反应
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890 kJmol-1、283 kJmol-1、285.8 kJmol-1,计算下列反应的反应热。CO2(g)+CH4(g)= 2CO(g)+ 2H2(g) ΔH=____kJmol-1。
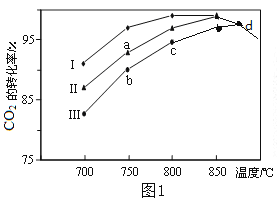
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2![]() CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH______0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是_______________。
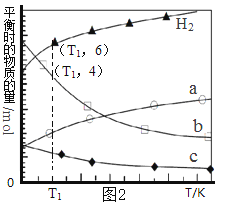
(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在__________自发进行(填“低温”或“高温”)。
②c代表的物质是_______________。
③T1温度下的平衡转化率为__________________,相对于起始状态,平衡时气体的平均相对分子质量增大的百分率为_______________(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:

已知:①pH>4时,Fe2+易被氧气氧化;
②相关物质的溶解度曲线如图。
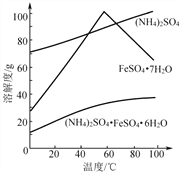
(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3 溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是____________。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 ________。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为__________。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是____________。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式:____________。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,____________,过滤,得到较纯净的FeSO4溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
___________________________________________________。
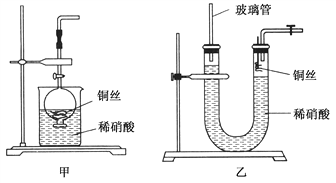
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是____________________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反就开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是___________________________________。
②让反应停止的操作方法及原因是________________________。
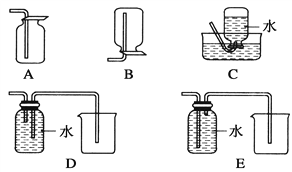
(4)以下收集NO气体的装置,合理的是________(填选项代号)。
(5)假设实验中12.8 g Cu全部溶解,需要通入标况下________mL O2才能使NO全部溶于水。
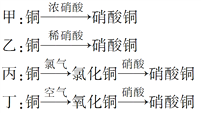
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I. ![]() U是重要的核工业原料,在自然界的丰度很低。
U是重要的核工业原料,在自然界的丰度很低。![]() U的浓缩一直为国际社会关注。回答下列有关问题:
U的浓缩一直为国际社会关注。回答下列有关问题:
(1)![]() U表示的含义是________________。
U表示的含义是________________。
(2)![]() U、
U、![]() U、
U、![]() 互为同位素,下列对同位素的理解不正确的是________(填序号,下同)。
互为同位素,下列对同位素的理解不正确的是________(填序号,下同)。
A.元素符号相同 B.物理性质相同
C.化学性质基本相同 D.在周期表中位置相同
(3)下列有关![]() U说法不正确的是________。
U说法不正确的是________。
A.![]() U原子核的中子数与质子数之差为51
U原子核的中子数与质子数之差为51
B.![]() U与
U与![]() U的质子数、电子数都相等
U的质子数、电子数都相等
C.![]() U与
U与![]() U是两种质子数相同,中子数不同的原子
U是两种质子数相同,中子数不同的原子
D.![]() U与
U与![]() U是同种原子
U是同种原子
Ⅱ.锂的材料在社会生活中广泛应用,如亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,LiCoO2作便携式电源的正极材料,碳酸锂(Li2CO3)广泛应用于陶瓷和医药等领域。根据下列要求回答相关问题:
(1)Li和Li作核反应堆最佳载热体,LiH和LiD作高温堆减速剂。下列说法中 正确的是________(填序号,下同)。
A.Li和Li互为同位素 B.Li和Li属于同种核素
C.LiH和LiD的化学性质不同 D.LiH和LiD是同种物质
(2)下列说法不正确的是________。
A.碱性:Be(OH)2<LiOH<NaOH<KOH B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+ D.金属性:Cs>Rb>K>Na>Li>Be
(3)锂是碱金属族首元素,其性质明显不同于其他碱金属性质,下列能支持这一观点的性质是________。
A.碱金属与水反应 B.碱金属在氧气中燃烧
C.碱金属与氢气反应 D.碱金属与氯气反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com