
科目: 来源: 题型:
【题目】下列除杂质的操作中不正确的是
A. 铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B. FeCl2溶液中混有FeCl3加入过量铁粉充分反应后过滤
C. Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D. AI(OH)3中混有Mg(OH)2:加入足量烧碱溶液后过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目: 来源: 题型:
【题目】若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
A. 氢键分子间作用力非极性键 B. 氢键氢键极性键
C. 氢键极性键分子间作用力 D. 分子间作用力氢键非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述不正确的是
A. 明矾可以对自来水杀菌
B. 在医疗上碳酸氢钠可用于治疗胃酸过多
C. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是
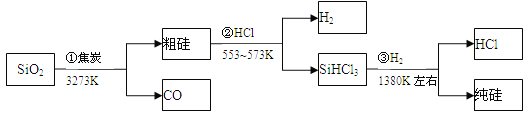
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目: 来源: 题型:
【题目】【2016年北京Ⅰ卷】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4溶液 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ: 。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是 。
②通过下列实验证实,沉淀中含有Cu2+和SO32。
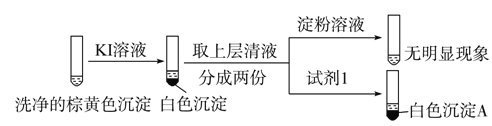
a.白色沉淀A是BaSO4,试剂1是 。
b.证实沉淀中含有Cu2+和SO32的理由是 _。
(3)已知:Al2(SO4)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和 。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i.被Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
a.将对比实验方案补充完整。
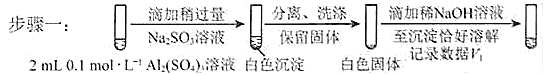
步骤二: (按上图形式呈现)。
(4)根据实验,亚硫酸盐的性质有 。盐溶液间反应的多样性与 有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取电解二氧化锰(EMD)的工艺流程如下:
I.将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II.向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III.过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV.将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2+
FeS2+![]() MnO2+
MnO2+![]() _____=
_____=![]() Mn2++
Mn2++![]() Fe2++ S + SO42-+
Fe2++ S + SO42-+![]() ____
____
(2)加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。(结合离子方程式解释)
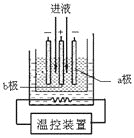
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是__极(填“a”或“b”),生成EMD的电极反应式是_________。
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是_______(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目: 来源: 题型:
【题目】某二元酸H2A在水中的电离方程式是H2A=H++HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1) Na2A溶液显 (填“酸性”、“中性”或“碱性”),理由是 (用离子方程式或必要的文字说明)。
(2) 常温下,已知0.1 mol·L-1NaHA溶液pH=2,则0.1 mol·L-1H2A溶液中氢离子的物质的量浓度可能 0.11 mol·L-1(填“大于”、“等于”或“小于”), 理由是 。
(3) 0.1 mol·L-1NaHA溶液中各种离子浓度由大到小的顺序是
(4) Na2A溶液中,下列表述正确的是
A.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
B.c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
C.c(OH-)=c(HA-)+c(H+)+2c(H2A)
D.c(OH-)=c(HA-)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在10 mL 0.2 mol·L-1氨水中,滴入0.2 mol·L-1的稀盐酸,使溶液的pH=7。则下列说法正确的是( )
A.加入盐酸的体积大于10 mL B.c(NH![]() )=c(Cl-)
)=c(Cl-)
C.加入盐酸的体积等于10 mL D.c(NH![]() )<c(Cl-)
)<c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】等物质的量浓度、等体积的下列物质的溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3下列关系或者说法正确的是( )
A.c(CO![]() )的大小关系为②>⑤>③>④>①
)的大小关系为②>⑤>③>④>①
B.c(HCO![]() )的大小关系为④>③>⑤>②>①
)的大小关系为④>③>⑤>②>①
C.将溶液蒸干、灼烧后只有①不能得到对应的固体物质
D.②③④⑤既能与盐酸反应,又能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com