
科目: 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g)2SO3(g),平衡混合体系中 SO3的百分含量和温度的关系如图1所示,根据图1回答下列问题:
①2SO2(g)+O2(g)2SO3(g)的△H____0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是____.
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4mol 电子,同时消耗2mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)2NH3(g).图2表示在此反应过程中的能量的变化,图3表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图4表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.

①该反应的平衡常数表达式为_____,升高温度,平衡常数______(填“增大”或“减小”或“不变”).
②由图2信息,计算0~10min内该反应的平均速率v(H2)=______,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为______(填“a”或“b”或“c”或“d”).
③图3a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______点,温度T1______T2(填“>”或“=”或“<”).
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_____性,所得溶液中c(H+)﹣c(OH﹣)=_________________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是重要的化工原料,工业上将NO2在密闭容器中经多次氧化,用水反复循环吸收制备硝酸。
(1)假定上述过程无其他损失,试写出上述反应的化学方程式:______________________;
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置己略去)。

①检査装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入__________至U形管右侧胶塞下沿后,迅速关闭K1,U形管内反应的化学方程式是_________________。
②蘸NaOH溶液的棉花团的作用是____________;
③装置Ⅲ的作用为_________________________;
④打开K2,长玻璃管中液面上升,____________则证明NO也可以与氧气和水共同反应生成HNO3。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一瓶1 000 mL、含25% NaClO、密度是1.19 g.cm-3的“84消毒液”,使用时需要稀释100倍(体积比),密封保存。下列分析不正确的是
A. 该“84消毒液”中NaClO物质的量浓度为4.0 mol·L-l
B. 该“84消毒液”稀释100倍后,Na+的物质的量浓度为0. 04 mol·L-l
C. 空气中的CO2与“84消毒液”发生反应的化学方程式是NaClO+CO2+H2O= NaHCO3+ HClO
D. 用容量瓶配制上述浓度的“84消毒液”480 mL,需要称量的NaClO固体质量为143.0 g
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室保存下列试剂,其中保存方法和理由描述都正确的是 ( )
编号 | 试剂 | 保存方法 | 理由 |
A | 白磷 | 保存在煤油中 | 防止与空气中水、氧气接触发生反应 |
B | 液溴 | 密封保存在细口瓶中 | 防止升华 |
C | 氯水 | 存放在磨口玻璃塞的棕色瓶中 | 避免见光分解 |
D | 氢氟酸 | 存放在磨口玻璃塞的广口瓶中 | 防止挥发 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y 原子最外层电子数是次外层电子数的2倍:Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1) 元素X原子结构示意图为_________________。
(2) 元素Y的一种同位素可测定文物年代,这种同位素的符号是______________。
(3) 元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为_________________________。
(4) ZW3可与水反应生成一种酸和一种碱,反应的化学方程式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修5:有机化学基础】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
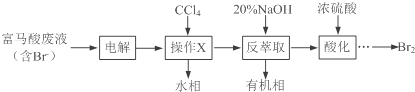
(1)操作X所需要的主要玻璃仪器为____________;反萃取时加入20%的NaOH溶液,其离子方程式为________________________.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是_________.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是____________________________.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
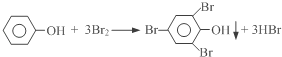
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:____________________________,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为____________mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量_________________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目: 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现如图所示的物质之间的变化:
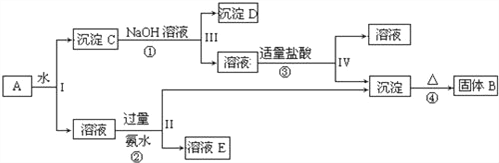
据此回答下列问题:
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是_____.
(2)根据上述框图反应关系,写出下列B、C、D、E所含物质的化学式
沉淀固体B______;C________;沉淀D_____;溶液E________.
(3)写出①、②、③、④四个反应方程式
①_________________________;
②________________________;
③________________________;
④________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列将饱和碘水中的碘单质分离出来的实验操作说法正确的是
A.使用萃取的方法,并选用酒精作萃取剂
B.萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液
C.分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一烧杯中
D.从分液漏斗中分离出的就是纯净的碘单质
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
4C(g)+6D(g)在5L的密闭容器中进行,半分钟后,C的物质的量增加了0.3mol。下列论述正确的是
A.A的平均反应速率是0.010mol·L-1·s-1
B.容器中含D的物质的量至少为0.45mol
C.容器中A、B、C、D的物质的量比—定是4∶5∶4∶6
D.容器中A的物质的量一定增加了0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com