
科目: 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
pC(g)在密闭容器中进行,如图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
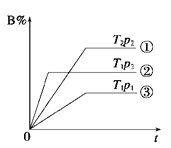
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(气)+3B(气)![]() 2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
2C(气)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C ,则下列说法正确的是( )
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,B的体积分数减小
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列各组物质之间不能通过一步反应实现如图所示转化关系是
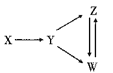
选项 | X | Y | Z | W |
A | Mg | Mg3N2 | MgCl2 | Mg(OH)2 |
B | Al | NaAlO2 | Al(OH)3 | AlCl3 |
C | N2 | HNO3 | NO | NO2 |
D | NaCl | Cl2 | HCl | HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是
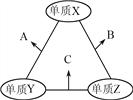
A. X元素位于ⅥA族
B. A难溶于B中
C. A和C不可能发生氧化还原反应
D. B的沸点高于C的沸点
查看答案和解析>>
科目: 来源: 题型:
【题目】钴及其化合物在工业中运用广泛,从某工业废料中制备草酸钴的工业流程如图:
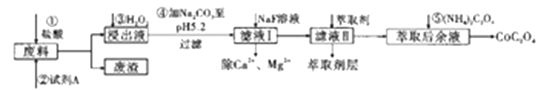
已知:①废料中主要含有三氧化二钴。含少量F2O3、Al2O3、MnO、CaO、SiO2等;
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
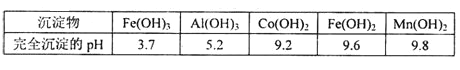
(1)在浸出过程中加入Co2O3与盐酸反应生成气体,此反应的离子方程式为___________________ ;实验室中检验该气体的方法是________________。
(2)加入试剂A的目的是_________________,废渣的主要成分是_______________,在浸出液中先加入双氧水反应,再加入碳酸钠的原因是(试用离子方程式和必要的文字简述其理)___________。
(3)萃取后余液中加入(NH4)2C2O4沉淀Co2+,判断Co2+沉淀完全的操作是____________________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示,在滤液II中适宜萃取的pH为_____(填序号)
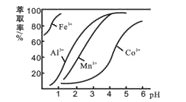
A.接近2.0 B. 接近3.0 C. 接近5.0
(5)在空气中加热CoC2O4固体,经测定,210℃~290℃的过程中只产生CO2和一种化合物,该化合物中钴元素的质量分数为73.44%。此过程发生反应的化学方程式是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】影响化学反应速率的因素很多,同学们用以下实验的进行探究。
(1)实验一:经研究知Fe3+、Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验(其它实验条件相同)。
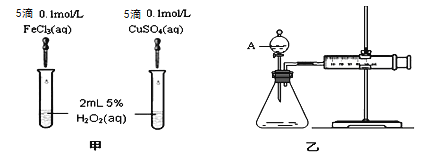
①定性分析:如图甲可通过观察产生气泡的快慢来比较反应速率的大小,比较得出结论。若图甲所示的实验中反应速率为左边>右边,能否一定说明Fe3+比Cu2+对H2O2分解的催化效果更好 (填“能”或“否”),其理由是____________________(若能说明催化效果,此空不填) 。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。用简单的方法检验该装置的气密性 。实验中需要测量的数据是: 。
(2)实验二:高锰酸钾酸性(稀硫酸酸化)溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
① 写出酸性高锰酸钾溶液和草酸溶液反应的化学方程式: 。
②针对上述实验现象,某同学认为KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是 的影响。
若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是 。(填序号)
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(3)实验三 已知 KI溶液在酸性条件下能与氧气反应。 现有以下实验记录:
实验编号 | ① | ② | ③ | ④ | ⑤ |
温度(℃) | 30 | 40 | 50 | 60 | 70 |
显色时间(s) | 160 | 80 | 40 | 20 | 10 |
① 该反应的离子方程式为_____________________。
② 完成此实验,试剂除了1 mol/L KI溶液、0.1 mol/L H2SO4溶液外,还需要的试剂是______________,
实验现象为 。
③ 由上述实验记录数据可得出的结论是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】中和滴定的相关问题
Ⅰ.下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)无“0”刻度的是 (填字母)。
(2)下列操作合理的是 (填字母)。
A.用25 mL碱式滴定管量取20.00 mL NaOH溶液
B.用托盘天平准确称量10.20 g碳酸钠固体
C.用100 mL量筒量取3.2 mL浓硫酸
D.用500 mL容量瓶配制1 mol·L-1的氢氧化钠溶液495.5 mL
Ⅱ. 某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是 ___(填编号)。
(2)判断滴定终点的现象是: 。

(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据,请计算待测盐酸的浓度: mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |
(5)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是 (填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应N2+O22NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
A.缩小体积使压强增大
B.降低温度
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质和应用正确的是( )
A. 福尔马林可用于保存海鲜产品
B. 油脂在酸性条件下可水解生成高级脂肪酸和甘油
C. 乙醇、糖类和蛋白质都是人体必需的营养物质
D. 合成橡胶与光导纤维都属于有机高分子材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com