
科目: 来源: 题型:
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为 _________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:283.0kJmol1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)CH3OCOOCH3(g)+H2O(g)△H=15.5kJmol1
则2CH3OH(g)+CO(g)+1/2O2(g)CH3OCOOCH3 (g)+H2O(l)△H=_____。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________ ;
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是____(选填编号).
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×105 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。
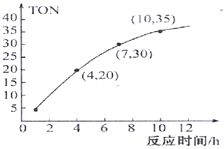
在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ .
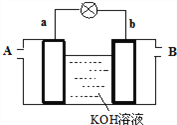
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
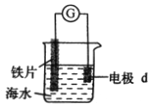
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+2H2O+4e ═ 4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++2e ═ H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
科目: 来源: 题型:
【题目】【2016四川】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
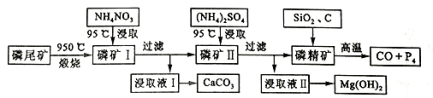
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知钡的金属活动性处于钾和钠之间。下列反应可以实现的是( )。
A.钡可以从氯化钠溶液中置换出钠
B.钡可与冷水反应并产生氢气
C.钡可以从氯化钾溶液中置换出钾
D.在溶液中,钡离子可与金属锌反应使之成为锌离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com