
科目: 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
探究一
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______选填序号)
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为____________。
探究二
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
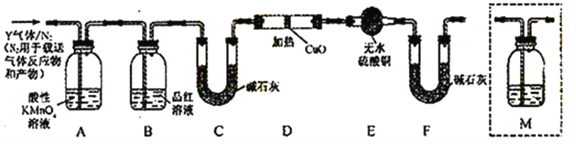
(3)装置B中试剂的作用是___________。
(4)认为气体Y中还含有Q的理由是___________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于____________(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用食盐水制取ClO2的工业流程如右图所示,
装置①中的反应:NaCl+3H2O![]() NaClO3+3H2↑,
NaClO3+3H2↑,
装置②中的反应: 2NaClO3+4HCl![]() 2ClO2+ Cl2↑+2NaCl+2H2O.
2ClO2+ Cl2↑+2NaCl+2H2O.
下列关于该流程说法不正确的是( )
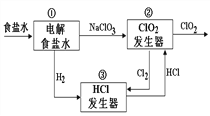
A. 该流程中Cl2、NaCl都可以循环利用
B. 装置①中H2是阴极产物
C. 装置②发生的反应中,Cl2是氧化产物,NaCl是还原产物
D. 为了使H2完全转化为HCl,需要向装置③中补充Cl2
查看答案和解析>>
科目: 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过KOH溶液,使用前未洗涤
D.定容时仰视刻度线和液面
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关工业生产的叙述不正确的是( )
A. 用海水淡化后的浓缩海水作原料提取溴
B. 在太阳能资源相对充足的沿海地区建造海水淡化厂
C. 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
查看答案和解析>>
科目: 来源: 题型:
【题目】某气态烃1体积只能与1体积HBr发生加成反应,生成溴代烷,此溴代烷1mol可与7mol Cl2发生完全取代反应,则该烃的结构简式为
A. CH2=CH2 B. CH3CH=CH2
C. CH3CH3 D. CH2=CH—CH=CH2
查看答案和解析>>
科目: 来源: 题型:
【题目】化学知识与生产生活息息相关。
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是__________(写化学式),用于制造光导纤维的材料是__________(写化学式)。光导纤维在碱性土壤中易被腐蚀,请写出相关的离子反应方程式______________________
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成份是__________________(写化学式);漂白粉保存不当易变质,请写出漂白粉失效的方程式________________;如不小心把漂白粉与洁厕灵(主要成份为盐酸)混合,易生成氯气使人中毒。请写出有关反应的离子方程式________________________。
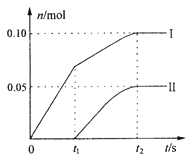
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=______________。
III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是_____________;
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是_______________
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是_____________
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是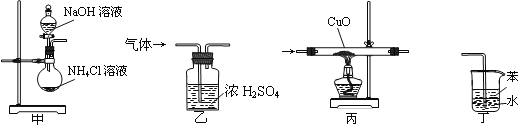
A.用装置甲制取氨气 B.用装置乙除去氨气中的水蒸气
C.用装置丙验证氨气具有还原性 D.用装置丁吸收尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com