
科目: 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的反应:2SO2(g) + O2(g) ![]() 2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
2SO3(g),下列说法能充分说明该反应已达到化学平衡状态的是
A. 正、逆反应速率都等于零 B. SO2、O2、SO3的浓度相等
C. SO2、O2、SO3在容器中共存 D. SO2、O2、SO3的浓度均不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目: 来源: 题型:
【题目】

请回答下列问题:
(1)A是一种能与溴水反应使其褪色的芳香烃,其结构简式为 。
(2)在上述合成路线发生的反应中属于取代反应的是 (填反应编号)。
(3)反应①发生时若不加入H2O2,会生成较多的一种副产物。写出这种副产物的结构简式 。
(4)写出由C→D 、 E→F转化的化学反应方程式 、 。
(5)在化合物E多种同分异构体中,只含有一种含氧官能团,且能与FeCl3溶液发生显色反应的同分异构体有 种(不考虑羟基与碳碳双键直接连在一起的同分异构体),任写一种满足上述条件且核磁共振氢谱中有5个峰信号的同分异构体的结构简式 。
(6)按上述合成路线的表达形式,写出由![]() 制备
制备![]() 的合成路线。
的合成路线。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A 和 2 mol B 进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C, 下列说法正确的是( )
A. 该反应的化学平衡常数表达式是K=![]()
B. 此时,B 的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加 B,B 的平衡转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池。下图为碱性氢氧燃料电池结构示意图。
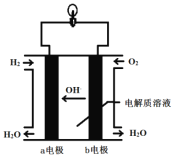
请回答下列问题。
(1)电池是将化学能直接转化为_________能的装置。
(2)氢氧燃料电池中发生反应的化学方程式是____________________。作为碱性氢氧燃料电池,该电池的电解质溶液可以是____________。
(3)b 电极上的反应为O2+2H2O+4e-![]() 4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
4OH-,则该电极为电池的______极。从氧化还原角度分析,该反应属于__________反应。
(4)氢氧燃料电池与普通电池相比,其优点是__________________(答出一点即可)。但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为_____能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
反应过程中测定的部分数据见下表(反应过程中条件不变):
t/s | 0 | 50 | 150 | 250 | 350 | 450 | |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x | |
请回答下列问题:
(1) x 的值是________;
(2) 0-50s 内,用PCl3的浓度变化表示的化学反应速率是________;
(3)250s 以后,Cl2的物质的量不再改变的原因是_______________;
(4) 250s 时,容器中Cl2的物质的量是_____,PCl5的物质的量是______,PCl5的转化率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868gcm-3的氨水。 (1)该气体的物质的量=_______mol;所得氨水的物质的量浓度= _______molL-1。 (2)若取上述氨水30.0mL与70.0mL2.00molL-1的AlCl3溶液相混合,产生白色沉淀的质量是___________g。
(3)若取一定体积浓度为5.00molL-1的NaOH溶液与50.0mL2.00molL-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,则NaOH溶液的体积为____________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
请判断 X、Y、Z,并用相应的元素符号回答下列问题。
(1)X是_____,它的原子M层电子数是_______。
(2)表中元素原子半径最大的是________。
(3)Y在元素周期表中的位置是第____周期第_____族,用电子式表示Y的最简单氢化物的形成过程_____。
(4)氮气中氮原子之间的化学键属于_____键,由氮气与氢气反应生成1mol氨气时转移电子的数目是______NA。
(5)硫与Z两种元素相比,非金属性强的是______,请用化学方程式说明这一结论____________。
(6)碳、氮、Y三种元素的最简单气态氢化物的稳定性由强到弱的顺序是________。由最高价碳元素与最低价氮元素组成化合物的化学式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校课外活动小组为探究铜与稀硝酸反应产生的气体主要是NO,设计了下列实验。图中K为止水夹,F是装有一半空气的注射器,其中十加热装置和固定装置均巳略去。请回答:
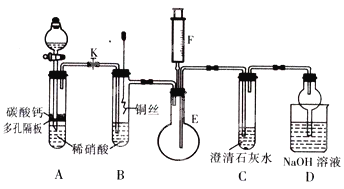
(1)设置装置A的目的是 ___________;实验开始后,如何判断A的实验目的已完成
________________________________。(2)当完成装置A的实验目的后,关闭K,再将装置B中的铜丝插入稀硝酸.B中反应的离子方程式为 ____________________ 。(3)将F中的空气推入E中,证明NO存在的实验现象是 ____________________________ ,
此过程发生反应的化学方程式是 ______________________________________________ 。 (4)装置D中NaOH溶液的作用是 ________________________________________ 。
写出可能发生的一个化学方程式___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
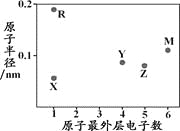
A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com