
科目: 来源: 题型:
【题目】
(1)下列物质中,属于弱电解质的是(填序号,下同) ,属于非电解质是 。
①硫酸氢钠固体 ②冰醋酸 ③蔗糖 ④氯化氢气体 ⑤硫酸钡 ⑥氨气 ⑦次氯酸钠
(2)写出下列物质在水中的电离方程式:醋酸: 。次氯酸钠: 。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
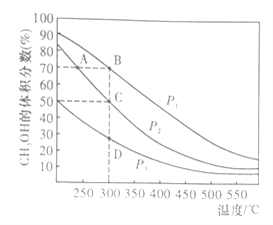
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取并收集氯气的装置如下图所示.请回答下列问题
(1)气体发生装置中进行的反应化学方程式是______
(2)当0.5mol MnO2参与反应时,被氧化的HCl的质量为 ______ ,生成的Cl2在标准状况下的体积约为 ______ .
(3)在装置中:①饱和食盐水的作用是 ______ ,②浓硫酸的作用是 ______ .
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸.如果有Cl2产生,可观察到的现象是______ .
(5)写出尾气吸收装置中进行的反应的离子方程式______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
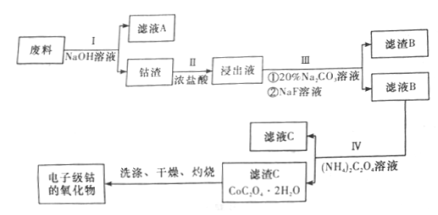
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________;
步骤I得到的滤液A中的溶质为___________(填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________;滤渣B的主要成分为____________。
(4)步骤I、III、IV中均用到的分离提纯方法为_______,在实验室中完成该操作用到的玻璃仪器是__。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.25 |
400~500 | 2.41 |
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________,400℃~500℃所得固体的化学式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是
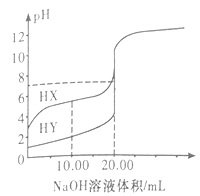
A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,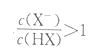
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读明代爱国诗人于谦的诗《石灰吟》,回答问题:
千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间
(l)整首诗蕴含着石灰的来源、生产、性质、用途等多种化学事实,诗中所描述的变化共涉及到下列物质:①石灰石(主要成分CaC03)②Ca0③C02④H20⑤Ca(OH)2悬浊液⑥CaC03,其中属于电解质的是______(填序号)
(2)下列工业生产中一般不用石灰石作为原料的是______(填序号)
①用海水为原料生产镁 ②制硅酸盐水泥 ③制普通玻璃 ④制漂白粉⑤制陶瓷
(3)零食包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰,生石灰属于_____氧化物(填“酸性”或“碱性”),用方程式说明你的理由________.
(4)某兴趣小组同学对碳酸钙的制备进行了以下探究,该组同学使用大理石(含少量的Fe203杂质)等物质制备碳酸钙的实验流程如图:
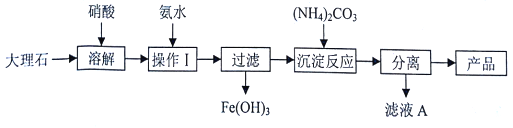
溶解大理石时,用硝酸而不用硫酸的原因是____,“滤液A”中除H+离子外,还含有的阳离子是_____;检验该阳离予的实验操作是______.
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是
A.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
B.淀粉、油脂和蛋白质都是高分子化合物
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.聚氯乙烯塑料薄膜可用作食品保鲜膜、一次性食品袋等
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 蒸馏 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 过滤 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的分类结果全部正确的是( )
A. 水煤气-混合物 胆矾-纯净物 臭氧-单质
B. 纯碱-碱 硫化氢-酸 小苏打-酸式盐
C. 油脂-高分子化合物 纤维素-天然高分子化合物 有机玻璃-合成高分子化合物
D. 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】下列现象或事实可用同一原理解释的是( )
A. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B. SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
C. 漂白粉和水玻璃长期暴露在空气中变质
D. 氢氧化铁液溶胶和蛋白质溶液中分别加入硫酸铜溶液时均产生沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com