
科目: 来源: 题型:
【题目】Ⅰ.某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:

(1)该反应的化学方程式为____________________;
(2)反应开始至2min,以气体Z表示的平均反应速率为______________________;
(3)平衡时容器内混合气体密度比起始时__________(填“变大”,“变小”或“相等”下同),混合气体的平均相对分子质量比起始时___________;
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:
n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_______(填序号,下同)。
2SO3(g)达到平衡状态的是_______(填序号,下同)。
(2)一定能证明I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 _________。
2HI(g)达到平衡状态的是 _________。
(3)一定能证明A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是________。
C(g)+D(g)达到平衡状态的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有3个H—H键断裂;
②一个N≡N键断裂的同时,有2个N—H键断裂;
③N2、H2、NH3浓度比为1:3:2
④保持其它条件不变时,体系压强不再改变;
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体的密度保持不变;
⑦正反应速率v(H2)=0.6mol/(L·min),逆反应速率v(NH3)=0.4mol/(L·min)
A.②⑤⑥ B.①④⑤ C.④⑤⑦ D.③⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.下图是由4个碳原子结合成的5种有机物(氢原子没有画出)
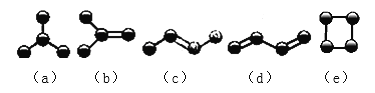
(1)写出有机物(a)的习惯命名法的名称______________ 。
(2)有机物(a)有一种同分异构体,写出其结构简式______________ 。
(3)上述有机物中与(c)互为同分异构体的是___________(填代号)。
(4)上述有机物中不能与溴水反应使其褪色的有______________(填代号)。
Ⅱ.写出烷烃C5H12的同分异构体中沸点最低的一种的结构简式_____________。
若此烷烃的一氯代物分子中含有两个-CH3,两个-CH2-,一个![]() 和一个-Cl,它的可能结构有四种,请写出它们的结构简式:_________________。
和一个-Cl,它的可能结构有四种,请写出它们的结构简式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目: 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢; 与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律:
(3)仪器B的名称为 ,干燥管D的作用为 .
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶除去.
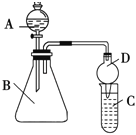
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,不属于取代反应的是( )
A. 淀粉在一定条件下水解生成葡萄糖
B. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
C. 在催化剂存在条件下,乙烯与水反应制乙醇
D. 油脂在碱性条件下水解制肥皂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )
A.盐酸和NaOH溶液混合
B.氯化氢溶于水
C.溴化氢气体与氨气相遇反应
D.锌和稀硫酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。通常情况下,ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。ClO2易发生爆炸,在生产、使用时可用其它气体进行稀释。ClO2易与碱反应生成亚氯酸盐和氯酸盐。
(1)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠,可较安全地生成ClO2,反应的离子方程式为___________。
(2)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO2-存在于中性溶液中):
①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式_____________。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00ml,判断达到滴定终点的方法是_________。该水样中ClO2的浓度是___mg/L。
(3)某学习小组设计如下装置进行制取亚氯酸钠(NaClO2)。

①装置A中产生的ClO2气体,在装置C中反应生成NaClO2,写出生成NaClO2的化学方程式为_______。将NaClO2溶液在一定条件下处理即可得到NaClO2晶体。
②装置B的作用是____________。
③某同学认为上述装置并不完整,请画出需补充的装置图____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com