
科目: 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
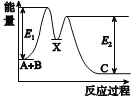
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝在氯气中燃烧生成CuCl
C.纯净的氢气可以在氯气中安静地燃烧,发出黄色火焰
D.向田鼠洞里通入氯气杀灭田鼠,利用了氯气有毒和密度较大的性质
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B===C+D,8g A和12g B恰好完全反应,生成C和9g D,则生成C的质量为( )
A. 9g B. 11g C. 10g D. 12g
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年12月1日,华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2 ![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用质子交换膜
B. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-= Li1-xCoO2+xLi+
C. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D. 废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目: 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O (l) △H=-57.3 KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
查看答案和解析>>
科目: 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )
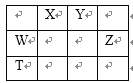
A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目: 来源: 题型:
【题目】T1 K时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是
CO2(g)+H2(g),反应过程中测定的部分数据如表(表中t2>t1)所示,下列说法错误的是
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A.用H2表示反应在t1 min内的平均速率为v(H2)=![]() mol·L1·min1
mol·L1·min1
B.保持其他条件不变,t1时向容器中充入3.00 mol N2,达到平衡时,n(CO2)=1.20 mol
C.保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO的转化率将增大
D.温度升至T2 K,上述反应的平衡常数为0.70,则正反应的ΔH<0
查看答案和解析>>
科目: 来源: 题型:
【题目】Sorbicillin (简称化合物X)是生产青霉素时的一个副产品,其结构简式如右下图所示。 下列有关化合物X的说法正确的是
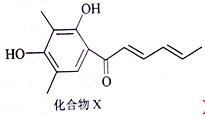
A. 分子中所有碳原子可能处于同一平面
B. 1 mol化合物X可以与2 mol Na2CO3反应
C. 1mol化合物X可以与浓溴水发生取代反应消耗3molBr2
D. 化合物X与H2完全加成,每个产物分子中含有4个手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(L·s)②v(B)=0.6mol/(L·s)
③v(C)=0.4 mol/(L·s)④v(D)=0.45 mol/(L·s)
该反应进行的快慢顺序为( )
A.④>③=②>① B.④<③=②<①
C.①>②>③>④ D.④>③>②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com