
科目: 来源: 题型:
【题目】现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g) ![]() 2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是
2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是

A. T1<T2
B. 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等
C. 温度为T2时,2s内B的平均速率为0.3mol·L-1·s-l
D. 温度为T1时,达平衡时反应物A的转化率为60%
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是_______;如果研究温度对化学反应速率的影响,使用实验Ⅰ和___________(Ⅰ~Ⅳ表示)。
(3)实验Ⅳ中加入1 mL蒸馏水的目的是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成的原电池如图所示,则负极发生的电极反应为__________________________;当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是___________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池.某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液.
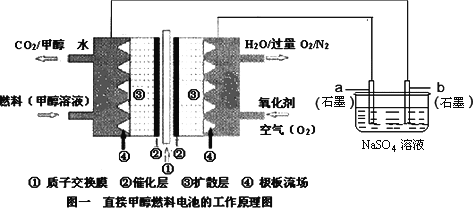
请根据图示回答下列问题:
(1)图中a电极是_____________(填“正极”、“负极”、“阴极”或“阳极”).该电极上发生的电极反应式为__________________.
(2)碱性条件下,通入甲醇的一极发生的电极反应式为________________.
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是____________mol.
(4)若a、b电极材料分别为铁和石墨,则电解总反应化学方程式为____________
查看答案和解析>>
科目: 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
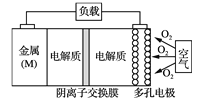
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质间的转化,能经过一步化合反应直接转化的是( )
A.SiO2→H2SiO3
B.Na2O2→Na2CO3
C.Fe→Fe(OH)3
D.Al2O3→Al(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是:
A. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
B. Fe(OH)3胶体无色、透明,能发生丁达尔现象
C. 漂白粉、水煤气、氨水、胶体均为混合物
D. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件多化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ molL-1 | 体积/mL | 浓度/ molL-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,标况下,每生成89.6L CO2气体,转移 mol 电子。写出H2C2O4与酸性KMnO4溶液反应的离子方程式:
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 。本实验通过测定 来判断反应的快慢。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ molL-1min-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2 mol/L、0.4 mol/L。当反应达到平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2 mol/L、0.4 mol/L。当反应达到平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4 mol/L B. SO2为0.5 mol/L
C. SO3为0.8 mol/L D. SO2、SO3均为0.3 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com