
科目: 来源: 题型:
【题目】下列叙述错误的是
A. 用金属钠可以区分乙醇和乙醚
B. 用高锰酸钾酸性溶液可区分己烷和3-己烯
C. 用水可区分苯和溴苯
D. 用新制的银氨溶液可区分甲酸甲酯和乙醛
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应2SO2+O2![]() 2SO3达到平衡的标志是( )
2SO3达到平衡的标志是( )
①消耗2molSO2的同时生成2molSO3
②SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
④恒容条件下压强保持不变
⑤一定体积下气体的密度保持不变
⑥v正(SO2)=2v逆(O2)
A.①②⑤ B.①③④ C.③④ D③④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】PFS是水处理中重要的絮凝剂,下图是以回收的废铁屑为原料制备PFS的一种工艺流程。
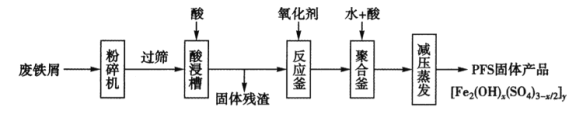
(1)酸浸槽以及聚合釜中用到的酸应是__________;PFS中铁元素的化合价为__________;在酸浸槽中,为了提高浸出率,可以采取的措施有_________(写两条)。
(2)若废铁属含有较多铁锈(Fe2O3·xH2O),则酸浸时反应的化学方程式有_____________。
(3)如果反应釜中用H2O2作氧化剂,则反应的离子方程式为________;生产过程中,发现反应釜中产生了大量的气体,且温度明显升高,其原因可能是___________。
(4)聚合釜中溶液的pH必须控制在一定的范围内。如果溶液酸性过强,造成的后果是________。如果溶液酸性太弱又会生成大量的氢氧化铁沉淀。若溶液中Fe3+的浓度为1mol·L-1,当Fe3+开始沉淀时,涪液的pH约为_________。[已知Fe(OH)3的Ksp≈1.0×10-39]。
查看答案和解析>>
科目: 来源: 题型:
【题目】向纯水中加入少量NaHSO4,在温度不变时,溶液中 ( )
A.c(H+)/c(OH-)增大 B.c(H+)减小
C.水中c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化稼(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]_______________。
(2)根据元素周期律,元素的电负性Ga______(填“大于”或“小于”, 下同)As,第一电离能B ____ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______。
(3)杀虫剂Na3AsO4中阴离子的空问构型为______,As原子采取________杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体。从F-和Cl-结构的不同分析其原因是____________。
(5)原子晶体GaAs的晶胞参数a=xpm,它的晶胞结构如下图所示。该晶胞内部存在的共价健数为______;A原子距离B原子所在六面体的侧面的最短距离为______ (用x表示)pm ;该晶胞的密度为_____g·cm-3。(阿伏伽德罗常数用NA表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等。在相同条件下将3mol A,1mol B分别同时混合于a、b两容器中,发生反应:3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
(1)达到平衡时,a中A的浓度为M mol/L。C的浓度为N mol/L,b中A的浓度为m mol/L,C的浓度为n mol/L,则M________m;N_________n(填>、<、=、无法比较)。
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后,a中C的浓度为N mol·L-1的是 ,b中C的浓度为n mo1·L-1的是 。
A、6molA+2molB
B、3molA+2molC
C、2molC+1molB+1molD
D、2molC+1molD
E、1.5molC+0.5molB+1molC+0.5molD
(3)若将2mol C和2mol D充入a中,保持温度不变,平衡时A的浓度为W mol·L-1,C的浓度为Y mol·L-1,则W和M,Y和N之间的关系为W_____________M,Y_____________N(填>、<、=、无法比较)。
(4)保持温度不变,若将4mol C和2mol D充入a中,平衡时A的浓度为R mo1·L-1,则 。
A、R=2M B、R<M
C、M<R<2M D、R>2M
查看答案和解析>>
科目: 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如下图所示(夹持仪器略去)。主要步骤如下:
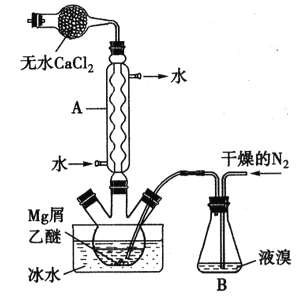
步骤l:三颈瓶中装入10g镁屑和150mL无水乙醚,装置B中加入适量的液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5= MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是___________,它在实验中的作用是____________。
(2)步骡2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是_____________。
(3)步骡3中,第一次过滤得到的固体物质是______;根据步骤3、4,请总结出三乙醚合溴化镁所具有的物理性质:_________。
(4)请根据Mg的性质设计实验证明O2的氧化性比N2的强:________。
(5)将步骤得到的产品在干燥器中冷却到室温后,称量,其质量为61.4g。则该实验制取MgBr2的产率是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com