
科目: 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol﹒L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钾用途较广,用于炸药、高级安全火柴、氧化剂及火箭、导弹推进剂等。工业制备氯酸钾有以下两种方法
方法一:电解热的饱和食盐水可以制得到氯酸钠,再与一定量的氯化钾进行复分解反应,即可得到硫酸钾,流程图如下:
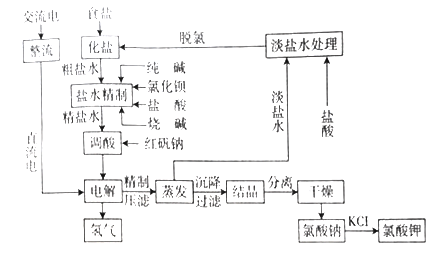
(1)①盐水精制时所加四种试剂是为了除去粗盐水中含有的_______等杂质离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品的顺序可以是_______________。
②加入足量纯碱时,会有部分BaSO4转化成BaCO3。若l.0L BaSO4的悬浊液中含0.010 mol BaSO4固体,需加入_______摩尔Na2CO3才能将BaSO4完全转化为BaCO3。 (已知/Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.5×10-9)
(2)电解热饱和NaCl溶液的离子方程式为__________。 通电开始后,阴极附近溶液pH会________(填“增大”“减小”或“不变”)。
(3)过滤用到的三个玻璃仪器为________________________。
(4)过滤后滤液仍然浑浊的可能的操作原因:向漏斗中加液体时液面高于滤纸边缘;______________。
(5)将得到的氯酸钠与一定量的氯化钾进行复分解反应, KCl+NaC1O3 = KC1O3+NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示。反应液经冷却至35℃以下时可析出氯酸钾晶体,原因是_______。在冷却降温析出KC1O3过程中,常伴有NaCl析出,分离出母液,将粗氯酸钾进行进一步提纯的方法是______________,操作步骤是蒸发浓缩、__________、过滤、洗涤、干燥,最后制得氯酸钾成品。

方法二:用热的石灰乳和氯气反应,再和氯化钾复分解反应制备:
(6)①C12转化为Ca(C1O3)2的化学方程式为_______________。
②提高Cl2转化为Ca(C1O3)2的转化率的可行措施有_________________。(填一条即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】学习了元素周期律的知识后,同学们设计了多个实验探究元素性质的递变规律。
Ⅰ.甲组同学根据元素非金属性与对应最高价含氧酸之间的关系,选取C、Si、S三种非金属元素的常见化合物,设计了如图装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究。
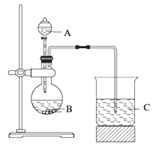
(1)甲组同学设计实验时,A中装H2SO4,则B,C中分别装
B____________________C__________________;
(2)烧杯C中发生反应的离子方程式 ____________________,
(3)通过实验得出的结论:元素非金属性强弱顺序为 ________________。(填元素符号)
Ⅱ.乙组同学认为利用图1装置可直接比较Cl2和S单质的氧化性强弱,他们选择的药品是浓盐酸,KMnO4固体, Na2S溶液。
(4)预计C中观察到的现象是__________________________________________________,
(5)C中反应的离子方程式为_____________________________________________________。
(6)有同学提出该装置存在明显缺陷需加以改进,你认为缺陷是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率 为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率 为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时A的浓度是__________;
(2)达平衡时B的转化率是__________;
(3)x的值是__________;
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香醛广泛存在于植物中,这类物质性质活泼,是合成染料、香料及药品的重要中间体,具有较大的工业价值。
已知:①芳香醛在碱作用下,可以发生自身氧化还原反应,生成相应的醇和羧酸。
②不饱和碳碳键上连有羟基不稳定。
③化合物A、B、C、D、E、F之间的转化关系如图36所示。其中,化合物A含有醛基, E和F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A物质间只有醛基参与反应,经红外光谱分析,F物质中含有两种常见的含氧官能团。
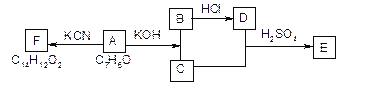
根据题目描述的信息,请你回答下列问题:
(1)写出C和D生成E的反应方程式:__________________________________________。
(2)A生成B和C的反应是_______,C和D生成E的反应是_________。
①.氧化反应②.加成反应③.消去反应④.酯化反应⑤.还原反应
(3)F结构简式是:______________________________________。
(4)F不可能发生的反应有_______。
①.氧化反应.加成反应③.消去反应④.酯化反应 ⑤.还原反应
(5)G物质是A物质的同系物,分子式是C9H10O。G物质苯环上含有两个取代基是与A含有相同官能团的同分异构体共用________种,写出其中一种的结构简式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定25.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是:

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)=1×10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:
c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时c(H+)=![]() +c(Z-)+c(OH-)
+c(Z-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
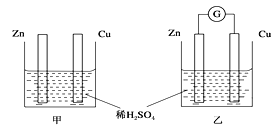
(1)以下叙述中,正确的是__________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F. 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式是:甲为__________;乙为__________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是______________________________________________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极: __________________,总反应: ________________________________。
当电路中转移0.25 mol电子时,消耗负极材料的质量为________________ (Zn的相对原子质量65)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于普通玻璃的叙述中,正确的是( )
A. 它是人类最早使用的硅酸盐材料
B. 红色玻璃中含氧化亚铜
C. 它在加热熔化时有固定的熔点
D. 无色玻璃是纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com