
科目: 来源: 题型:
【题目】表示下列用途或变化的离子方程式不正确的是:
A.泡沫灭火器灭火原理:Al3++3HCO3-===3CO2↑+Al(OH)3↓
B.纯碱代替洗涤剂洗涤餐具:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
C.明矾净水原理:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
D.NaHCO3的水解:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】化学工业中会产生大带含铬废水,需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法如下:向酸性废水中加入NaHSO3使Cr2O72- 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
① 写出NaHSO3与Cr2O72-反应的离子方程式:__________________________________。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31。若除去废水中Cr3+,使其浓度小于1×10-5 molL-1,此时溶液中的c(H+)<_________molL-1
(2)废水中铬元素总浓度的测定方法如下:向一定量含Cr2O72-和Cr3+的酸性废水样中加入足量(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O72-与I-完全反应后生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系如下:Cr3+ ![]() Cr2O72-
Cr2O72- ![]() I2
I2 ![]() S4O62-
S4O62-
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会________(选填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O72-和Cr3+的酸性废水样100.00 mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000 molL-1的Na2S2O3标准溶液13.50 mL。计算该废水中铬元素总浓度(以mg·L-1表示),写出计算过程。_____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)A~G各物质间的关系如下图,其中B、D为气态单质。
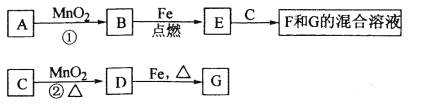
请回答下列问题:
(1)物质C和E的名称分别为 、 ;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为 ;
若只能在加热情况下进行,则反应物A的化学式(分子式)为 ;
(3)反应②的化学方程式为 ;
(4)新配制的F溶液应加入 以防止其转化为G。检验G溶液中阳离子的常用试剂是 (填化学式),实验现象为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A.x=1
B.2min内A的反应速率为0.3mol·L-1·min-1
C.B的转化率为50%
D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
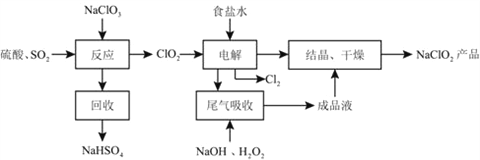
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式__________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下列反应在任何温度下均能自发进行的是:
A.2N2(g) + O2(g)![]() 2N2O(g) ΔH=+163 kJ·mol-1
2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s) +![]() Cl2(g)
Cl2(g)![]() AgCl(s) ΔH=-127 kJ·mol-1
AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)![]() Hg(l) +
Hg(l) +![]() O2(g) ΔH=+91 kJ·mol-1
O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)![]()
![]() O2(g) + H2O(l) ΔH=-98 kJ·mol-1
O2(g) + H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
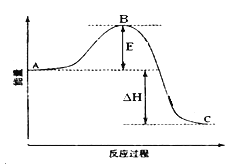
已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”)。
(2)图中△H= kJ·mol-1;
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= - 24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= - 47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A. 合成纤维和人造纤维可统称为化学纤维
B. 酚醛树脂和聚氯乙烯都是热固性塑料
C. 锦纶丝接近火焰时先蜷缩,灰烬为有光泽的硬块
D. 复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性能超过了单一材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com