
科目: 来源: 题型:
【题目】在F、P、S三种元素中,每种元素都有某些方面区别于其他两种元素;若从中选出氟元素,选择的理由是( )
A.单质与冷水反应非常剧烈
B.单质固态时属于分子晶体
C.一定条件下,能与氢气发生化合反应
D.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列室温下的溶液中,有关溶液中各粒子的浓度关系判断正确有
①0.1 mol·L-1CH3COOH溶液中:c(CH3COO-)=c(H+) - c(OH-)
②0.1 mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(NH![]() )>c(SO
)>c(SO![]() )>c(Cu2+)>c(H+)>c(OH-)
)>c(Cu2+)>c(H+)>c(OH-)
③等体积、等物质的量浓度的弱酸HX和NaX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
④pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+) >c(OH-)
⑤0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
⑥向醋酸钠溶液中加入醋酸,得到的酸性混合溶液中:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
⑦pH=7的NH3—NH4Cl混合溶液中:c(NH![]() )=c(Cl-)
)=c(Cl-)
⑧0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液的酸碱性可用酸度(AG)表示,![]() 。室温下,将0.0100molL-l盐酸逐滴滴入20.0mL 0.0100molL-l氨水中,溶液的AG变化如图所示。下列说法正确的是( )
。室温下,将0.0100molL-l盐酸逐滴滴入20.0mL 0.0100molL-l氨水中,溶液的AG变化如图所示。下列说法正确的是( )
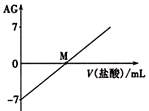
A. M点以后NH4+的水解程度逐渐增大
B. 室温下,0. 0100molL-l盐酸的AG =12
C. M点加入盐酸的体积大于20.0 mL
D. M点时溶液中:c(NH4+) =c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第______周期第_______族。
(2)E元素形成的氧化物对应的水化物的化学式为______。
(3)元素B、C、D、E形成的简单离子半径大小关系是_________。(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:_________。
(5)由A、B、C三种元素形成的离子化合物的化学式为_________,它与强碱溶液共热,发生反应的离子方程式是_________。
(6) D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为
_________。(化学式用具体的元素符号表示)。
(7)E的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的E的氧化物的含量。
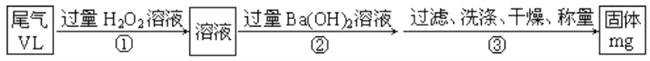 通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
通过的尾气体积为VL(已换算成标准状况)时,该尾气中E的氧化物含量(体积分数)为_______(用含有V、m的代数式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】巧妙的实验设计有助于更好地解决问题。下列装置不能达到实验目的的是
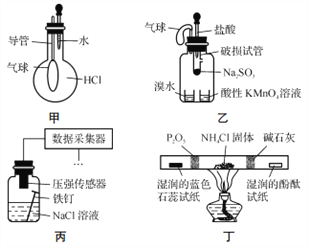
A. 用装置甲验证HCl气体易溶于水
B. 用装置乙验证SO2具有漂白性
C. 用装置丙采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀
D. 用装置丁检验NH4Cl分解产生的气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在充电过程中,阴极得到电子质量增加
B. 1 mol羟基含电子数约为7×6.02×1023
C. 0.1 molL-1 CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】元素①~⑩在周期表中的位置如表所示,试回答下列问题。
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)上述10种元素中,化学性质最不活泼的是_______(填元素符号,下同) ;与水反应最激烈的金属元素是_______。
(2)元素②的气态氢化物的分子式是_______;上述10种元素中,其最高价氧化物对应水化物的酸性最强的物质是_____(填化学式)。
(3)用电子式表示元素③与④形成1:2型化合物的形成过程_______。
(4)①②⑤元素的原子半径由小到大的顺序为_______(用元素符号表示) ③⑦⑩元素的气态氢化物的稳定性由强到弱的顺序为_______(用氢化物的化学式表示)。
(5)④和⑥两元素的最高价氧化物对应的水化物相互反应的离子方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
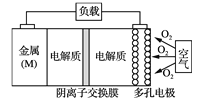
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】科学史上每一次重大发现都极大的推进了科学的发展,俄国科学家门捷列夫对化学的突出贡献在于( )
A.提出了元素周期律
B.开发了合成氨的生产工艺
C.揭示了燃烧的本质
D.提取了治疟药物青蒿素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com