
科目: 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. Cl2 D. H2O2
查看答案和解析>>
科目: 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气②煤③核能④水力发电⑤太阳能⑥燃料电池⑦风能⑧氢能
A. ①②③④ B. ③⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目: 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
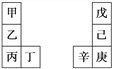
A. 金属性:甲>乙>丁
B. 乙的单质在空气中燃烧生成只含离子键的化合物
C. 原子半径:辛>己>戊
D. 丙与庚的原子核外电子数相差3
查看答案和解析>>
科目: 来源: 题型:
【题目】【2017届河南省南阳一中高三上周考五】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目: 来源: 题型:
【题目】目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境。这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验。【实验Ⅰ】硫的质量确定
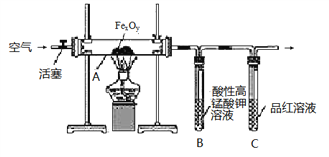
按图连接装置,检查好装置的气密性后,在硬质玻璃管A中放入1.00 g铁硫簇结构(含有部分不反应的杂质),在试管B中加入50.00 mL 0.1000 molL-1的酸性KMnO4溶液,在试管C中加入品红溶液。通入空气并加热,发现固体逐渐转变为红棕色。待固体完全转化后将B中溶液转移至250 mL容量瓶,洗涤试管B后定容。取25.00 mL该溶液用0.01000 molL-1的草酸(H2C2O4)进行测定剩余KMnO4溶液浓度的滴定。记录数据如下:
滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.50 | 23.70 |
2 | 25.00 | 1.02 | 26.03 |
3 | 25.00 | 0.00 | 24.99 |
相关反应:① 2MnO4- + 2H2O + 5SO2![]() 2Mn2+ + 5SO42- + 4H+
2Mn2+ + 5SO42- + 4H+
② 2MnO4- + 6H+ + 5H2C2O4![]() 2Mn2+ +10CO2↑+ 8H2O
2Mn2+ +10CO2↑+ 8H2O
【实验Ⅱ】铁的质量确定
将实验Ⅰ硬质玻璃管A中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经充分灼烧得0.600 g固体。
试回答下列问题:
(1)检查“实验Ⅰ”中装置气密性的方法是_______________。
(2)滴定终点的判断方法是______________。
(3)试管C中品红溶液的作用是_______________;有同学提出,撤去C装置,对实验没有影响,你的看法是___(选填“同意”或“不同意”),理由是________________。
(4)根据实验Ⅰ和实验Ⅱ中的数据可确定该铁硫簇结构的化学式为___________________。
【问题探究】
滴定过程中,细心的小明发现该KMnO4颜色褪去的速率较平常滴定时要快得多。为研究快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
(5)分析上述数据,滴定过程中反应速率较快的原因可能是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是从蛇床子果实中提取的一种中草药有效成分,是由碳、氢、氧元素组成的酯类化合物;B称作冰片,可用于医药和制香精,樟脑等;C的核磁共振氢谱显示其分子中含有4种氢原子;D中只含一个氧原子,与Na反应放出H2;F为烃。仔细阅读以下转化关系:
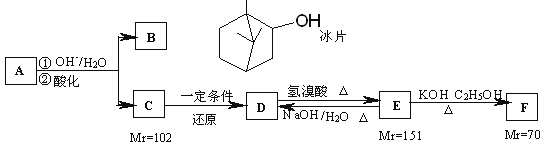

回答以下问题:
(1)B的分子式为__________。
(2)B不能发生的反应是___________(填序号)。
a.氧化反应 b.聚合反应 c.消去反应 d.取代反应 e.与Br2加成反应
(3)E→F的反应类型是____________。
(4)F的分子式为_________,化合物H是F的同系物,相对分子质量为56,H所有可能的结构有______种。
(5)用系统命名法给F命名的名称为______________。
(6)写出E→D的化学力程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,已知0.1mol﹒L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
① 常温下,0.1 mol﹒L-1 HA溶液的pH=_________;设计一个简单实验证明HA是强酸还是弱酸_________。
② pH=3的HA与pH= 11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:______________。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH______________14—a (>、<、=)
(3)向物质的量浓度均为0.01 mol﹒L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是______________,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。
(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)己知常温下CH3COOH的电离平衡常数为1.7×10-5,则该温度下CH3COO-的水解平衡常数等于____________(保留小数点后两位数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】【贵州省贵阳市2017届高三2月适应性考试(一)】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
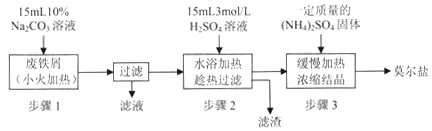
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】【江苏省联盟大联考2017届高三2月联考】.下列说法正确的是
A. 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0
B. 0.1mol/L氨水加水稀释后,溶液中![]() 的值减小
的值减小
C. 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D. 合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com