
科目: 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(SO42-)为 ( )
A. 0.15 mol/L B. 0.10 mol/L C. 0.25 mol/L D. 0.20 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. 6.8g固体KHSO4与3.9g固体Na2O2中阴离子数目相同
B. 常温下铁、铜均不溶于浓硫酸,说明常温下铁、铜与浓硫酸均不反应
C. 离子化合物中只含离子键
D. 已知:2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1,下图可表示由CO生成CO2的反应过程和能量关系

查看答案和解析>>
科目: 来源: 题型:
【题目】I、现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验。

(1)制取C2H2最好选④中的 装置(填“甲”“乙”或“丙”),所选用装置的连接顺序是 (填各接口A~E的顺序)。
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 。(保留3为有效数字)

II、某同学在实验室从如图标签的试剂瓶中取少许钠进行燃烧实验,实验后 发现还有少许黑色固体生成。从反应物及实验操作猜测:
该黑色物质可能为碳与另一种氧化物组成的混合物。
根据题意和图示回答下面问题:
(1)装置图⑤中A的名称 。
(2)此氧化物可能是 或 (写化学式)。
(3)对黑色固体物质的组成作如图⑥所示研究
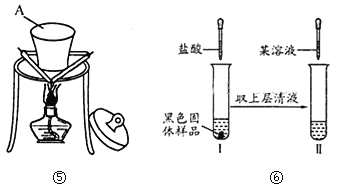
①实验I中加入盐酸溶液的目的是 。
②仅通过实验II,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)
实验操作 | 预期现象与结论 | 相关离子方程式 |
取少量实验I中的澄清溶液,加入试剂 |
查看答案和解析>>
科目: 来源: 题型:
【题目】用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是( )
A. 在烧杯中溶解时,有少量液体溅出 B. 样品中含有少量Na2O杂质
C. 容量瓶使用前未干燥 D. 定容时仰视视容量瓶刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
A.混合气体通过盛水的洗气瓶
B.混合气体通过装有过量溴水的洗气瓶
C.混合气体和过量H2混合
D.混合气体通过酸性KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:
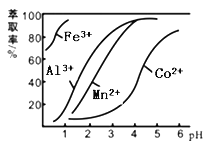
A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:E(P—P) = a kJ·mol-1、E(P—O) = b kJ·mol-1、E(P=O) = c kJ·mol-1、E(O=O) = d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
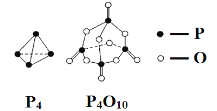
A.-(6a-12b-4c+5d)kJ·mol-1
B.-(-6a+12b+4c-5d)kJ·mol-1
C.-(-4a+6b+4c-5d)kJ·mol-1
D.-(4a-6b-4c+5d)kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO--)(填“>”、“=”或“<”,下同)。
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中c(Na+) = c(CH3COO--),则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(3)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO--)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有下列几种离子中的某几种:Ca2+、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量
、Cu2+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量![]() 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的![]() 溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
(1)溶液中一定不存在的离子是__,不能确定是否存在的离子是__.为确定该离子,应当补充的实验名称是______________
(2)溶液中肯定存在的阴离子有哪些?通过计算求出它们的物质的量浓度(或范围)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)氯化铝水溶液呈 性,原因是: (用离子方程式表示);把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)硫化钠溶于水时发生水解,其水解的离子方程式为 (只写第一步),在配制硫化钠 溶液时可以加入少量的 以抑制其水解。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com