
科目: 来源: 题型:
【题目】下列有关垃圾处理的方法不正确的是 ( )
A.垃圾处理常用的方法是卫生填埋、焚烧、堆肥
B.将垃圾分类回收是垃圾处理的发展方向
C.填埋垃圾不需处理,只深埋即可
D.焚烧垃圾产生大量污染空气的物质,故不易采用此方法
查看答案和解析>>
科目: 来源: 题型:
【题目】I.(1)比较原子半径的大小:O________F;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4_______H2SiO3
(3)稳定性:NH3________PH3
II.写出下列物质形成过程的电子式:
(4)HCl_________________________
(5)MgCl2 ______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量 变化最相符的是___________(填字母)。
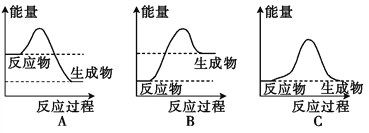
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:反应后生成产物的总能量_______(填“高于”或“低于”)碳酸钠晶体与硝酸铵晶体的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为光能和________;人们普遍使用的干电池工作时是将化学能转化为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用吸附了氢气的纳米碳管等材料制作的二次电池的原理如图所示。下列说法正确的是

A.充电时,阴极的电极反应为:Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为:H2-2e-+2OH-=== 2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O],又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:

(1)根据下列表格数据,选择消化反应的最佳温度__________;理由是___________________________。
消化温度/℃ | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
转化率/% | 50.3 | 58.2 | 85.1 | 85.2 | 90.7 | 91.2 | 91.5 |
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为____________。
(3)流程图中__________和__________可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol·L-1时,可以认为完全除去。常温时当调节溶液PH为9.5时,此时Mn2+小于__________mol·L-1,不会沉淀出来。
物质 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
Ksp | 10-11 | 10-39 | 10-17 | 10-14 |
②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为__________。
A.Ca(ClO)2 B.Cl2 C.H2O2 D.HNO3
③下列方案中,较好的为__________,理由是______________________。
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X的单质是一种理想能源,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为__________。
(2)上述元素中,非金属气态氢化物还原性最强的是_________(写化学式);Y和Z形成的含有共价键的化合物的电子式为_________。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_________。(写出其中两种物质的化学式)
(4)ZX与水剧烈反应产生X的单质,其化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为供源制备碳酸镁晶须(MgCO3·nH2O)的工艺如下:

已知“焙烧”过程中的主反应为:
Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)写出焙烧产物NH3的电子式__________。
(2)为提高水浸速率,可采取的措施为_________(任写一条)。“浸渣”的主要成分为________。
(3)“除铁、铝”时,需将pH调至8.0左右,适宜作调节剂的是_________(填字母代号)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉镁”过程中反应的离子方程式为________________。
(5)流程中可以循环利用的物质是________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
SO2(g)+NH3·H2O(aq)=NH4HSO3(aq)△H1=akJ·mol-1
NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l)△H2=bkJ·mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq)△H3=ckJ·mol-1
⑴反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=_____kJ·mol-1。
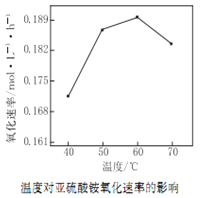
⑵空气氧化(NH4)2SO3的速率随温度的变化如图所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是_______。
⑶以磷石膏废渣和碳酸铵为原料制备硫酸铵,不仅解决了环境问题,还使硫资源获得二次利用。反应的离子方程式为CaSO4(s)+CO32—(aq)SO42—(aq)+CaCO3(s),该反应的平衡常数K=____。[已知Ksp(CaCO3)=2.9×10-9,Ksp(CaSO4)=9.1×10-6]
⑷(NH4)2SO4在工农业生产中有多种用途。
①将黄铜精矿(主要成分Cu2S)与硫酸铵混合后在空气中进行焙烧,可转化为硫酸铜同时产生氨气。该反应的化学方程式为________。
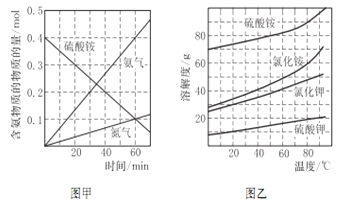
②研究硫酸铵的分解机理有利于对磷石膏的开发。在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图甲所示。写出该条件下硫酸铵分解的化学方程式,并用单线桥标出电子转移的方向及数目:_____________。
③(NH4)2SO4是工业制备K2SO4的重要原料。根据图乙中相关物质的溶解度曲线,简述工业上制备K2SO4晶体的设计思路:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯二氢硅(SiH2Cl2)常用于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl与硅在25O-260℃反应可以制得SiH2Cl2。

(1)利用浓硫酸、浓盐酸为原料,选用A装置制取HCl,利用了浓硫酸的_____性。
(2)D装置中生成二氯二氢硅的化学方程式为____________。
(3)按照气体从左到右方向,制取SiH2Cl2的装置(h 处用止水夹夹好)连接次序为____________a→ ( ) → ( )→ ( )→ ( )→ ( )→ ( )→ ( )(填仪器接口的字母,其中装置C用到2次)。
(4)按从左到右的顺序,前面装置C中装的药品为________,后面装置C的作用为________。
(5)反应除生成二氯二氢硅之外,还会生成H2和______、____。
(6)新的制取SiH2Cl2方法是:往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl在250-260℃反应,可以大大提高产率。如果通人气体次序相反,结果会_______(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com