
科目: 来源: 题型:
【题目】东汉《周易参同契》中记载:“胡粉投火中,色坏还为铅”,实验表明胡粉难溶于水,加强热产生能使澄清的石灰水浑浊的湿气.胡粉的主要成分
A. PbCO3 B. SnCO3Sn(OH)2 C. 2PbCO3Pb(OH)2 D. (CH3COO)2Pb
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为F2+2Cl-===Cl2+2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As,故前者的气态氢化物稳定性更强
④非金属性O>N,故O2与H2化合比N2更容易
A.②③ B.③④
C.①④ D.①②
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子或离子的立体构型判断不正确的是 ( )。
A.NH4+和CH4都是正四面体形
B.CO2和CS2都是直线形
C.NCl3和BCl3都是三角锥形
D.H2O和H2S都是V形
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 地沟油经过加工处理可用来制肥皂
B. NH3的水溶液可以导电,说明NH3是电解质
C. 糖类、油脂、蛋白质均为高分子化合物
D. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
查看答案和解析>>
科目: 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
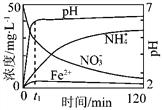
(1)实验前:①先用0.1 mol·L-1H2SO4洗涤Fe粉,其目的是_________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入________(写化学式)。
(2)图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式 _____________ 。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三
假设一:溶液的pH;假设二:__________________; 假设三:__________________;
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO![]() 浓度可用离子色谱仪测定)__________________
浓度可用离子色谱仪测定)__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的回收利用是环保领域研究热点。
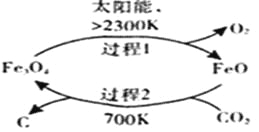
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
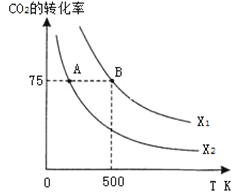
①平衡常数KA KB
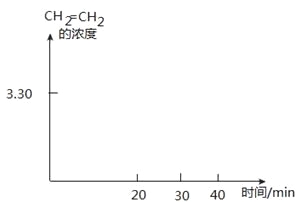
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0
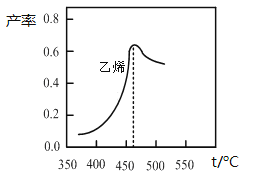
上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
查看答案和解析>>
科目: 来源: 题型:
【题目】在1×105 Pa和298 K时,将1 mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ·mol-1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3,
2NH3,
断开1 mol N2中的化学键需_____ (填“吸收”或“放出”)945 kJ能量,形成2 mol NH3中的化学键需_____ (填“吸收”或“放出”) ________ kJ能量;
在298 K时,取1 mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为____________ kJ。
根据上表中的数据判断工业合成氨的反应是______(填“吸热”或“放热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com