
科目: 来源: 题型:
【题目】加热N2O5时,发生以下两个分解反应:N2O5![]() N2O3+O2,N2O3
N2O3+O2,N2O3![]() N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是
A.c(N2O5)=1.44 mol/L B.c(N2O5)=0.94 mol/L
C.c(N2O)=1.40 mol/L D.c(N2O)=3.48 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
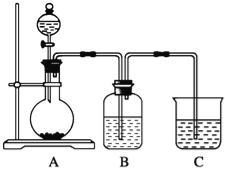
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律.
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为 ,C中可观察到的现象是 .
(2)B装置的作用是 .
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是 ,由此得出碳、硅、氮三种元素非金属性的强弱顺序是 .
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱.
(4)写出B装置中发生反应的离子方程式: .
(5)C装置的作用是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() Mn0(s)+CO2(g)△H1 K1
Mn0(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n)+O2(g)![]() 2MnO2(s)+2CO2(g)△H3 K3
2MnO2(s)+2CO2(g)△H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s)![]() MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
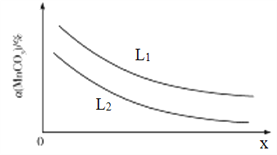
比较:L1__________L2(填“>"“<”或“=")。
②保持温度不变,将容器休积扩大至原来的2倍,则ρ(CO2)的变化范围是____________。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为____________L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、B、C、的单质, x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且y可用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是

A. D的单质起火燃烧时可用y作灭火剂
B. 元素的非金属性:C>A>B>D
C. B、C、D与A形成的简单化合物的熔点:C>D>B
D. 原子半径:D>B>C>A
查看答案和解析>>
科目: 来源: 题型:
【题目】50 mL 0.50mol·L-1盐酸与50 mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。回答下列问题:
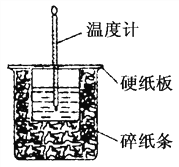
(1)小烧杯中发生反应的离子方程式为: ________________________________;
(2)该实验中反应发生过程中,温度计显示温度上升,说明该反应是__________反应(填”放热”或”吸热”)
(3)从能量的角度看,断开化学键要________________;形成化学键要_________________________;
(4)将实验中的药品换为铝片和稀盐酸,温度计显示温度上升。发生反应的化学方程式为______________________,反应物的总能量__________生成物的总能量(填”大于”或”小于”)
(5)目前,全球仍主要处于化石能源时期,下列有关能源说法正确的是__________;
A.煤、石油、天然气属于矿石能源,是取之不尽用之不竭的,可以大量使用
B.沼气的主要成分是甲醇,是一种清洁能源
C.太阳能、氢能、核能等以后将成为提供能源的重要形式
D.可利用风能发电来缓解枯水季节的电能不足
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na2SO4 和 Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为
A.0.15mol/L B.0.45mol/L C.0.6mol/L D.0.3mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】可以充分说明反应 P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是
R(g)+S(g)在恒温下已达到平衡的是
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1︰1︰1︰1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com