
科目: 来源: 题型:
【题目】氢氧燃料电池是一种化学电源,如图所示,以石墨为电极,两极分别通入氢气和氧气,KOH溶液为电解质溶液,下列说法不正确的是( )

A. 在电池反应中每转移2mol电子,正极消耗O2的体积为11.2L
B. b极的电极反应式为:O2+2H2O+4e-=4OH-
C. 工作一段时间后,电解质溶液碱性减弱
D. 该装置将化学能转化为电能
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两化学活动小组对中学化学教材中“氨的催化氧化”进行了实验探究。
(1)甲小组设计了如图l所示的实验装置(固定装置已略去)。
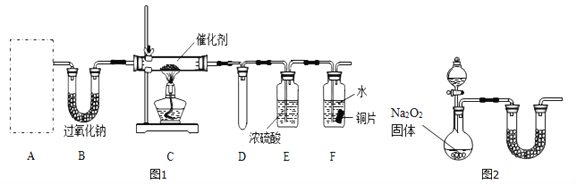
①若装置A中使用的药品是NH4HCO3固体,则A需要的仪器有试管、导管、橡胶塞和_____(填选项序号)。
a.锥形瓶 b.酒精灯 c.烧瓶 d.蒸发皿
②装置B的作用是______________;装置D的作用是____________。
③装置C中发生反应的化学方程式为_________________。
④若A、B中药品足量,则可以观察到装置F中的实验现象是_______________。
⑤该装置存在的主要缺陷是____________________。
(2)乙小组认为可将甲小组的装置中A、B部分换成如图2所示装置(其余部分相同)进行实验。
①烧瓶中加入的是过氧化钠固体,则分液漏斗中加入的最佳试剂是______,U型管中加入试剂是______。
②实验室制备氨气的化学反应方程式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)和亚硝酸钠在化工生产及航天工业中具有十分广泛的应用,下图是以液氨为原料生产肼和亚硝酸钠的工艺流程(肼能与水混溶,形成稳定的N2H4H2O):
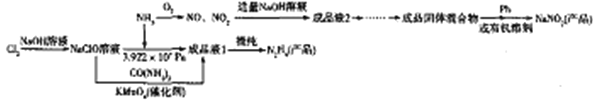
回答下列问题:
(1)NaNO2中N的化合价为_______。
(2)写出在NaClO溶液中通入NH3得到成品液1的化学反应方程式:______________。
(3)由成品液2得到成品固体混合物需经过的操作步骤为________________。
(4)亚硝酸钠在一定条件下能与无水肼反应生成一种钠氮化合物和水,生成的钠氮化合物中钠的质量分数为35.38%。则反应中氧化剂与还原剂的物质的量之比为_____;该反应中的氧化产物是___________________。
(5)已知所得成品固体混合物中含有2种钠盐,若要获得NaNO2产品,则需要除去的物质为_______(填化学式);使用Pb进行处理时,杂质能转变为NaNO2,而Pb转化成PbO,则这一处理过程发生反应的化学方程式为___________;已知,NaNO2在邻苯二甲酸二丁酯中溶解度远大于在水中的溶解度,而另一钠盐则不具有该性质,若用有机溶剂邻苯二甲酸二丁酯处理成品固体混合物水溶液时,NaNO2 与另一钠盐通过_____(填操作名称)被分离。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验事实:
(1)X+Y2+===X2++Y
(2)Z+2H2O![]() Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+离子的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e-===Y2+
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
A. X>Y>Z>W B. Y>X>W>Z
C. Z>X>Y>W D. Z>Y>X>W
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:_____________;
(2)写出氮气分子的结构式____________。
Ⅱ.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。
含有极性键和非极性键的是_______;
含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④硫酸溶于水;⑤蔗糖溶于水;⑥HI分解;⑦碘升华;⑧溴蒸气被木炭吸附。
(1)未破坏化学键的是_____________;
(2)仅离子键被破坏的是_____________;
(3)仅共价键被破坏的是_____________。
Ⅳ.下列物质:①1H、2H、3H ;②H2O、D2O、T2O;③O2、O3;④14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知正四面体形分子![]() 与线型分子
与线型分子![]() 反应,生成四面体形分子
反应,生成四面体形分子![]() 和直线型分子
和直线型分子![]() 。组成
。组成![]() 分子中的元素的原子序数都小于10,组成
分子中的元素的原子序数都小于10,组成![]() 分子的元素为第三周期的元素。如下图,则下列判断中正确的是( )
分子的元素为第三周期的元素。如下图,则下列判断中正确的是( )
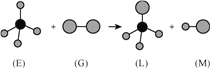
A. 常温常压下, ![]() 是一种液态有机物 B.
是一种液态有机物 B. ![]() 是一种含有非极性键的分子
是一种含有非极性键的分子
C. 干燥的![]() 能漂白有色物质 D. 上述反应的类型是取代反应
能漂白有色物质 D. 上述反应的类型是取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】右图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
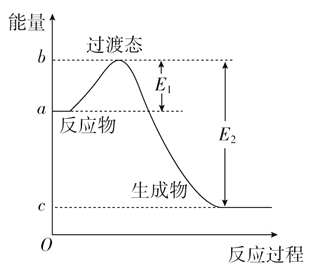
A. 若在反应体系中加人催化剂,E1不变
B. 若在反应体系中加入催化剂,△H减小
C. 反应的活化能等于y kJmol-1
D. 1 mol SO2Cl2(g)和1 mol SCl2(g)反应生成SOCl2(g)的△H=(x-y) kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是部分短周期元素原子半径与原子序数的关系如图,则下列说法正确的是( )
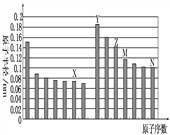
A . Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数如下表:
MnO2 时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
10 mL 1.5% | 223 s | 67 s | 56 s |
10 mL 3.0% | 308 s | 109 s | 98 s |
10 mL 4.5% | 395 s | 149 s | 116 s |

请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性: 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而_______(填“加快”或“减慢”或“不变”)。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g(填“ 0.1 g”或“ 0.3 g”或“ 0.8 g”) 的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确___________(填“正确”或“ 不正确”),理由是___________________________。(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com