
科目: 来源: 题型:
【题目】下列工业产品的生产设计中原子利用率没有达到100%的是
A.合成甲醇:CO + 2H2![]() CH3OH
CH3OH
B.合成乙醛:2CH2=CH2 + O2![]() 2CH3CHO
2CH3CHO
C.合成全降解聚碳酸酯塑料:![]()
D.合成有机玻璃单体-甲基丙烯酸甲酯:
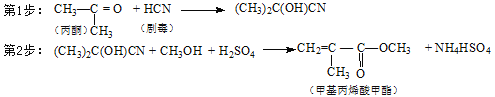
查看答案和解析>>
科目: 来源: 题型:
【题目】现有如下仪器,仪器中已注入溶液,回答下列问题。

(1)加热装置A,写出铜与浓硫酸反应的化学方程式:_______________________________
(2)验证碳、硅非金属性的相对强弱(已知酸性:H2SO3>H2CO3),若选择仪器A、B、C、D并相连接,则B、C、D中所选择的试剂为B________、C________、D________。能说明碳的非金属性比硅强的实验现象是_________________。
(3)验证SO2的氧化性、还原性。若选择A、E、F仪器,并按A、E、F顺序连接。
①则证明SO2有氧化性的实验现象是________________,反应方程式为________________。
②若证明SO2具有还原性,在E中采取的实验操作为_________________________________,
其实验现象为__________________,反应原理为__________________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,如果取0.1molL-1HA溶液与0.1molL-1NaOH溶液等体积混合,测得混合液的pH=8。混合液中由水电离出的OH-浓度与0.1molL-1NaOH溶液中由水电离出的OH-浓度之比为__________.
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的
①0.1molL-1硫酸铝溶液
②0.1molL-1氯化钡溶液
③蒸馏水
④0.1molL-1硫酸溶液中,
Ba2+浓度由大到小的顺序是 。(用序号填写)
(3)常温下,将a molL-1的氨水与0.1molL-1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3H2O的电离常数Kb= 。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用乙醇和浓硫酸制取乙烯,其反应式为CH3CH2OH![]() CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:
CH2=CH2↑+H2O实验时常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2.回答下列问题:

I、II、III、IV装置可以盛放的试剂有:
A、品红溶液 B、NaOH溶液
C、浓硫酸 D、酸性KMnO4溶液(试剂可以重复使用)
(1)I、II、III、IV装置中所盛的试剂分别为:_________、_________、_________、_________(填序号)
(2)使用装置II的目的是_________________。
(3)确定含有乙烯的现象是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2= Na2S2O5。
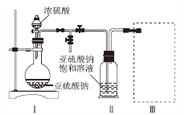
(1)装置Ⅰ中产生气体的化学方程式为______________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。

实验二 焦亚硫酸钠的性质
已知:Na2S2O5溶于水即生成NaHSO3。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是 ____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对碱性锌锰干电池的废旧资源进行回收利用:
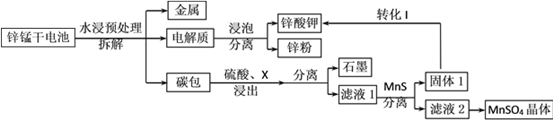
已知:①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
⑴碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为2MnO2+ Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式_____________;
⑵为了提高碳包的浸出效率,可以采取的措施有________________________;(写一条即可)
⑶向滤液1中加入MnS的目的是__________________________________________;
⑷已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;

⑸为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如表1,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式_____________。
⑹工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是___________________________________;
⑺该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定测定Mn2+在电池中的百分含量,化学方程式可以表示为Mn2++Y2-=MnY。实验过程如下:
准确称量一节电池的质量平均为24.00g,完全反应后,得到200.00mL滤液2,量取10.00mL滤液2稀释至100.00mL,取20.00mL溶液用0.0500molL-1EDTA标准溶液滴定,平均消耗标准溶液22.00mL,则该方案测得Mn元素的百分含量为________。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】硅单质及其化合物在材料领域一直扮演重要角色。下列叙述中,不正确的是( )
A. 石英可用来制作工艺品 B. 硅单质可以用来制造太阳能电池
C. 硅单质是制造玻璃的主要原料 D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
科目: 来源: 题型:
【题目】用NaCl固体配制一定物质的量浓度的溶液时,操作要领包括:①溶解;②定容;③转移;④计算;⑤称量⑥洗涤⑦摇匀等方面,其正确的操作顺序是( )
A. ①②⑥③④⑤⑦ B. ④①②⑥③⑤⑦
C. ④⑤①③⑥②⑦ D. ④⑤③⑥②①⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 醋酸的导电性比强酸溶液弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com