
科目: 来源: 题型:
【题目】海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用:_______________________ (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通人到阴极室中,理由是_____________________。
②A口排出的是__________________(填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+ Cl-、Br-等离子)可提取溴,其生产流程如下: 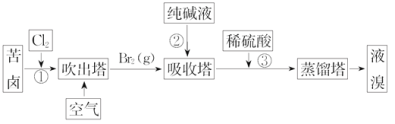
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为:____________________.
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液?______________。
③向蒸馏塔中通人水蒸气加热,控制温度在90°C左右进行蒸馏的原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是
A. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. ![]() 与
与![]() 得电子能力相同
得电子能力相同
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________________
(2)在测定中和热的实验中,计算反应热时需要的数据有________________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_______ (填“相等”或“不相等”),所放出的热量____ (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会_____(填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。已知:①下图为反应的能量变化和物质键能
CH3OH(g)。已知:①下图为反应的能量变化和物质键能


②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)为自发进行的氧化还原反应,将其设计成如右图所示的原电池,下列说法中正确的是( )
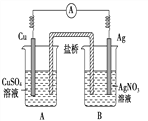
A. 铜电极是正极,其电极反应为Cu-2e-===Cu2+
B. 当铜电极质量减少0.64 g时,电解质溶液中有0.02 mol电子通过
C. 装置盐桥中可装有含琼脂的KCl饱和溶液
D. 银电极上发生还原反应,电极质量增加
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质发生变化时,所克服的微粒间作用力属于同种类型的是( )
A.二氧化硅和氢氧化钠的熔化
B.碘和干冰的升华
C.氯化氢和氯化钠的溶解
D.汞和硫的气化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知W、X、Y、Z是短周期元素,aW3+、bX+、cY2﹣、dZ﹣四种离子具有相同的电子层结构,下列关系正确的是( )
A.最外层电子数:Y>Z
B.核电荷数:a>b
C.稳定性:H2Y>HZ
D.X单质一定能从W的盐溶液中置换出W单质
查看答案和解析>>
科目: 来源: 题型:
【题目】月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为__________。
(2)Na的原子结构示意图为_________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为:_________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收, 则生成的盐为__________(写化学式)。
(4)月壤中含有丰富的3He,月壤中提炼1kg3He,同时可得6000kgH2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产破酸氢铵________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
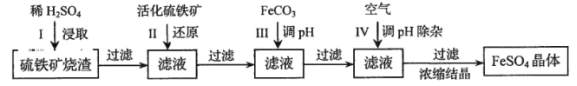
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s) ![]() =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) ![]() =-393kJ/mol
=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ![]() =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中发生反应H2(g)+I2(g)![]() 2HI(g)ΔH<0,达到平衡时,下列说法正确的是( )
2HI(g)ΔH<0,达到平衡时,下列说法正确的是( )
A.向容器中加入惰性气体,平衡向右移动
B.加入催化剂,HI的产率增大
C.降低温度,H2的转化率减小
D.无论平衡正向或是逆向移动时,混合气体的平均分子量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】高聚物的合成与结构修饰是制备具有特殊功能材料的重要过程。下图是合成具有特殊功能高分子材料W( )的流程:
)的流程:

已知:(R、R1、R2代表烃基)
I、![]()
![]() RCH2OH
RCH2OH
II、![]()
⑴反应①的反应类型是_______________。
⑵反应②是取代反应,其化学方程式是___________________________________________。
⑶D的核磁共振氢谱中有两组峰且面积之比是1:3,不存在顺反异构。D的结构简式是______。
⑷反应⑤的化学方程式是__________________________________________________。
⑸G的结构简式是__________________。
⑹反应⑥的化学方程式是__________________________________________________。
⑺工业上也可用![]() 合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件,
合成E。由上述①~④的合成路线中获取信息,完成下列合成路线(箭头上注明试剂和反应条件, 不易发生取代反应)__________________
不易发生取代反应)__________________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com