
科目: 来源: 题型:
【题目】在一定温度下,将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.5,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=________
CO2(g)+H2(g)的平衡常数K2=________
(3)已知在1000 ℃时,该反应的平衡常数K3=1.0,则该反应为_________反应(填“吸热”或“放热”)。
(4)在1 000 ℃下,从开始到20s时反应达到平衡状态,则CO浓度为____________mol/L,CO2的转化率为____________。此温度下,若某时刻CO2的物质的量为2 mol,则此时v正______________v逆(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:
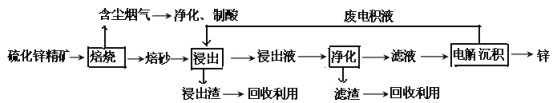
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为____。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体_。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中给出几种氯化物的熔点和沸点:

有关表中所列四种氯化物的性质,有以下叙述:
①氯化钠晶体中微粒间以分子间作用力结合;②工业上可以用电解熔融的氯化镁制取镁;③氯化铝在加热时能升华;④氯化铝晶体是典型的离子晶体;⑤四氯化硅在晶态时属于分子晶体。其中,正确的是( )
A. ①② B. ③④ C. ③⑤ D. ②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用下图实验装置探究盐桥式原电池的工作原理,按照要求依次回答下列问题:

(1)写出该氧化还原反应的离子方程式:_______________
(2)装置中盐桥中除添加琼脂外,还要添加KCl的饱
和溶液,电池工作时,对盐桥中的K+、Cl-的移
动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(3)已知该原电池装置在反应前两电极质量相等,一段时间后两极质量相差12.9 g
则导线中通过的电子数目为________ (用“NA”表示);
(4)有人以化学反应:2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则原电池的负极材料是________,正极发生的电极反应为:__________________。
(5)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:①则d电极是________(填“正极”或“负极”)C电极的反应方程式为:_____________

②若电路中转移4 mol电子,则上述燃料电池消耗的O2在标准状况下的体积为____L。
③电池工作一段时间后溶液的酸性_________(填“增强”“减弱”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mo | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.容器②中达平衡时放出的热量Q=23.15 kJ
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.平衡时,两个容器中NH3的体积分数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】有如下两个反应:(1)Cu+2Fe3+=Cu2++2Fe2+(2)Fe+Cu2+=Fe2++Cu。判断Fe3+、Fe2+、Cu2+氧化性强弱顺序排列正确的是
A. Fe3+>Cu2+>Fe2+
B. Cu2+>Fe3+>Fe2+
C. Fe3+Fe2+>Cu2+
D. Fe2+>Cu2+>Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】①丁烷 ②2一甲基丙烷 ③戊烷 ④2一甲基丁烷 ⑤2,2—二甲基丙烷等物质的沸点排列顺序正确的是 ( )
A. ①>②>③>④>⑤ B. ⑤>④>③>②>①
C. ③>④>⑤>①>② D. ②>①>⑤>④>③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质①HCl②CO2③H2O④H2⑤NaHSO4⑥Cl2⑦NaF⑧CH4⑨CaO⑩MgCl2
(1)属于离子化合物的是_______,只含共价键的是______,既含有离子键又有共价键的是______。
(2)属于电解质的是__________,属于非电解质的是___________。
(3)将NaHSO4熔化,破坏了NaHSO4中的__________键,写出其电离方程式_____________。将NaHSO4溶于水,破坏了NaHSO4中的_________键,写出其电离方程式_____________。
(4)分别用电子式表示氯化镁、氯气的形成过程:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com