
科目: 来源: 题型:
【题目】
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
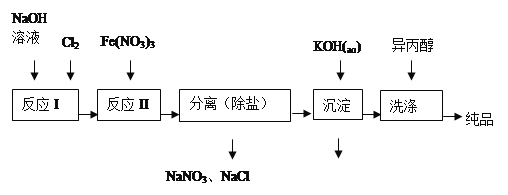
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:

(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是( )
A. 采取低碳、节俭的生活方式
B. 按照规定对生活废弃物进行分类放置
C. 深入农村和社区宣传环保知识
D. 经常用一次性筷子、纸杯、塑料袋等
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学知识判断以下观点不正确的是
①放热反应不需要任何条件就能进行 ②原电池装置中化学能转化为电能 ③原电池工作时发生的反应一定是氧化还原反应 ④加热时化学反应速率增大 ⑤化学反应达到平衡时反应不再进行
A. ①②④ B. ①⑤ C. ②③⑤ D. ①④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对制取水泥和玻璃的共同特点的叙述中,错误的是
A. 生产设备相同 B. 原料中均有石灰石
C. 反应都在高温下进行 D. 发生的都是复杂的物理化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:氮气和氢气合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
2NH3(g) ΔH=-92kJ/mol。请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量____92kJ(填“大于”、“等于”或“小于”);若升高温度,上述反应中ΔH____(填“变大”、“变小”或“不变”)。
(2)已知:分别破坏1molN![]() H键、1mol H
H键、1mol H![]() H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N![]() N键需要吸收的能量为___________。
N键需要吸收的能量为___________。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g)并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(Lmin),则N2(g)+3H2(g)![]() 2NH3(g)反应的平衡常数为___________。
2NH3(g)反应的平衡常数为___________。
查看答案和解析>>
科目: 来源: 题型:
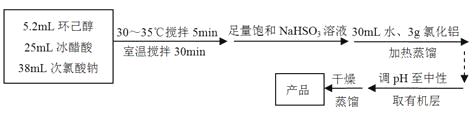
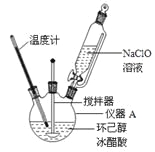
【题目】
环己酮:无色或浅黄色透明液体,有强烈的刺激性臭味,密度(相对水=1):0.95,熔点:-45℃,沸点:155℃,溶解度(100mL H2O):2.4g(31℃)。
主反应:
回答下列问题:
(1)仪器A的名称是 。
(2)在反应开始的5min,为了将体系温度维持在30~35℃,除了用冰水浴冷却外,采取的措施还有 、 。
(3)加入饱和NaHSO3溶液时发生的主要反应是 (用离子方程式表示),确保加入的饱和NaHSO3溶液已经足量的实验操作是 。
(4)为将馏出液的pH调至中性,可以加入的试剂是 。
A.稀盐酸 | B.无水碳酸钠 | C.浓硫酸 | D.氢氧化钠固体 |
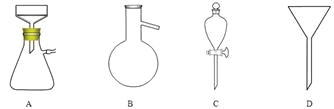
(5)调节pH后还需加入精制食盐,其目的是 ,“取有机层”时使用的主要仪器是 。(填下图对应的字母)。
(6)实验条件的优化对实验成败至关重要,小组成员觉得有必要对NaClO溶液的最佳浓度进行探究。他们配制了一系列不同浓度的NaClO溶液,并用滴定法标定。具体方法是:用移液管取10.00mL NaClO溶液于500mL容量瓶中定容,取25.00mL于锥形瓶中,加入适量稀盐酸和KI固体(足量),用0.1000mol/L Na2S2O3标准溶液滴定至终点(用淀粉溶液作指示剂),三次平行实验平均消耗Na2S2O3标准溶液18.00mL,已知I2+2Na2S2O3==2NaI+Na2S4O6 。则该NaClO溶液的浓度是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.增大反应物浓度可增大活化分子百分数,所以反应速率增大
B.放热反应的反应速率一定大于吸热反应的反应速率
C.反应NH3(g) + HCl(g)![]() NH4Cl(s)在室温下可自发进行,则该反应的△H<0
NH4Cl(s)在室温下可自发进行,则该反应的△H<0
D.对于反应X(s)+aY(g)![]() bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
bZ(g)+W(g) △H>0,升高温度,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com