
科目: 来源: 题型:
【题目】已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
化学物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | a | 369 |
则表中a为( )
A.404 B.260 C.230 D.200
查看答案和解析>>
科目: 来源: 题型:
【题目】C、CH4是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量分别为393.5 kJ、890.3 kJ。计算说明:(写出必要的文字说明和重要演算步骤,只写出最后答案的不能得分。有数值计算的题,数值结果保留到小数点后1位。)
(1)1 g C完全燃烧时放出的热量。
(2)完全燃烧相同质量的C和CH4,哪种燃料放出热量较多?
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2A![]() B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
B + D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示,表中温度为摄氏度(℃)。
实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1. 0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据述数据,回答下列问题 :
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为________ 。
(2)在实验1中,c1数值为 ________ 。
(3)在实验1、2中有一个实验使用了正催化剂。判断是实验 ________ (选填“1”或“2”)使用了正催化剂。
(4)在实验1、3中反应温度不同。判断T3 ________ 800(选填“﹤”或“﹥”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
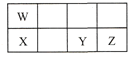
A. 原子半径大小:X > Y > Z
B. W、Y两种元素都能与氧元素形成化合物WO2、YO2
C. 最高价氧化物对应水化物的酸性:W > Y > Z
D. W元素的单质能从X的氧化物中置换出X单质
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,将10mL 0.1mol/L Na2S2O3溶液和10mL 0.1mol/L的H2SO4溶液混合,3min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速度增大到原来的3倍,那么40℃时,同样的反应要同样看到浑浊,需要的时间是
A.40s B.15s C.30s D.20s
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
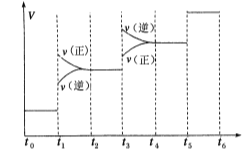
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确是( )
①生成物的质量分数一定增加
②生成物的产量一定增大
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
⑥平衡常数一定增大
A.①② B.③⑤ C.②⑤ D.④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com