
科目: 来源: 题型:
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:
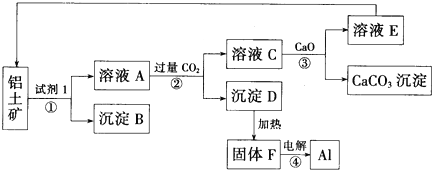
请回答:
(1)试剂1为____________(填化学式),①~④转化过程中____________消耗能量最多;
(2)沉淀B的化学式为__________,该物质除了用于金属冶炼以外,还可用作_____________;
(3)电解F,当转移6mol电子时,可制得铝 _____________g;
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有__________(填化学式);
(5)②中发生反应的离子方程式为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S,已知甲池中发生的反应:
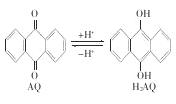
下列说法正确的是( )
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-=H2AQ
B. 乙池溶液中发生的反应为H2S+I3-=3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
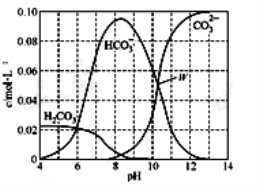
A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X ,其结构如图所示,下列说法正确的是( )
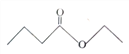
A. X难溶于乙醇
B. X的分子式为C6H10O2
C. 酒中的少量丁酸能抑制X的水解
D. 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体异构)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关电解质溶液下列说法正确的是
A.等体积、等浓度的Na2CO3、NaHCO3溶液混合后,3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
B.常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-)
C.若一元酸酸性HA>HB,则等体积、等浓度的NaA与NaB溶液中,前者的离子总数小于后者
D.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
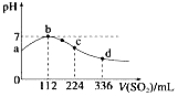
A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为_________,S、O、N三种元素的第一电离能由大到小的顺序为_________。
(2)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4] (NO3)2。其中NO3-中心原子的杂化轨道类型为_________,[Cu(NH3)4]NO3)2中存在的化学键类型除了极性共价键外,还有_________。
(3)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,CN-中提供孤电子对的原子是_________, lmol CN-中含有的π键的数目为_________。与CN-互为等电子体的离子有_________ (写出一种即可)
(4)CuSO4的熔点为560°C,,Cu(NO3)2的溶点为115°C,CuSO4溶点更高的原因是_________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O ,其晶胞结构如图所示。

该晶胞原子坐标参数A为(0,0,0);B为(1,0,0) ;C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
)。则D原子的坐标参数为_________,它代表_________原子(填元素符号)。
②已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是_________,该晶胞中Cu原子的空间利用率是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。
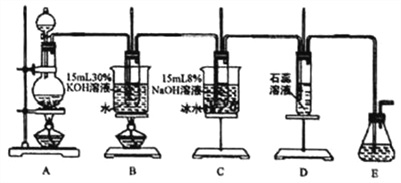
实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式________________________________。
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、_________、_________。为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是_________。
(3)装置 C 中反应需要在冰水浴中进行,其原因是________________________________。
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为_________色。
实验Ⅱ 尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32- ;假设2:既不存在SO32-也不存在ClO-;假设 3:_________。
②设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01mol/L酸性 | (1)若溶液褪色,则假设1成立 |
KMnO4溶液 | (2)若溶液不褪色,则假设2或3成立 |
步骤3:_____ | _____ |
查看答案和解析>>
科目: 来源: 题型:
【题目】[2016全国Ⅲ]下列有关实验的操作正确的是
实验 | 操作 | |
A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com