
科目: 来源: 题型:
【题目】有些中国古文或谚语包含了丰富的化学知识,下列解释不合理的是
选项 | 古文或谚语 | 化学解释 |
A | 粉身碎骨浑不怕,要留清白在人间 | 发生了化学变化 |
B | 以曾青涂铁,铁赤色如铜 | 化合反应 |
C | 煮豆燃豆箕 | 化学能转化为热能 |
D | 雷雨肥庄稼 | 自然固氮 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】PbO主要用做电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体。下图是用某工业废渣(含PbSO435%,其余为CaSO4)生产PbO的主要流程。
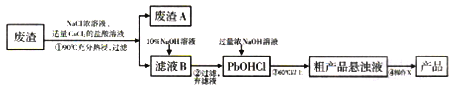
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是__________________(填化学式)。
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为_______;加入CaCl2的目的是________________。
(3)“滤液B→PbOHCl”的离子方程式为_________________。
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)__________、___________、过滤、干燥。
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为_______(保留三位有效数字)。(已知:Pb2++H2Y=PbY+2H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4
D.其它条件不变的情况下,加入催化剂可提高CO的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1) 上述实验中发生反应的化学方程式有:
__________________、_____________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
(4) 要加快上述实验中气体产生的速率,还可以采取的措施有:
_____________________、___________________________(举两种)。
(5) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下的一系列的实验。将表中所给的混合溶液分别加到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需要的时间。
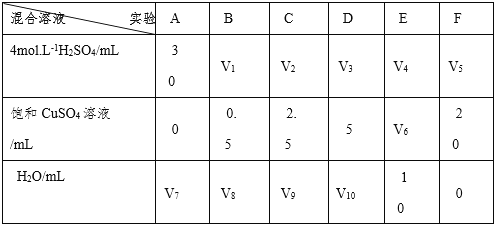
①请完成此实验设计,其中:V1 =____;V6 = ____;V9=____;
②反应一段时间后,实验E中的金属呈____色;
③该同学最后得出结论为:当加入少量硫酸铜溶液时,生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:______________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=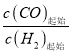 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:

回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化钛(TiCl4)是制取航天工业材料——钛合金的重要原料。实验室以TiO2和CCl4为原料树取液态TiCl4的装置如图所示(部分夹持装置省略)。
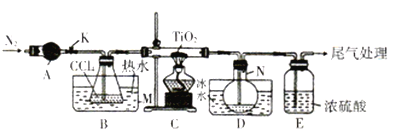
已知:有关物质的性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550 ℃时能被氧气氧化 |
请回答下列问题:
(1)仪器A的名称是________,仪器A中盛装的试剂是___________。
(2)CCl4的电子式为__________。
(3)装置C处硬质玻管中反应的化学方程式为__________________。
(4)TiCl4遇潮湿空气会产生TiO2,反应的化学方程式为________________。
(5)仪器N中收集到的物质主要有___________(写化学式),从产物中分离出TiCl4的实验方法是_____________。
(6)TiCl4还可由TiO2、焦炭和氯气在加热条件下制得,生成体积比为2∶1的CO和CO2混合气体,该反应中氧化剂与还原剂的物质的量之比为________。请设计实验方案验证产物气体中有CO:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常用药品羟苯水杨胺的合成路线如下。

已知:① ;
;
② ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)羟苯水杨胺的分子式为______,F含有的官能团名称是________。
(2)A的名称为___________。
(3)A→B所需试剂为______;D→E的反应类型属于_________。
(4)B→C反应的化学方程式为_____________。
(5)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的共有_____种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为l:2:2:1的同分异构体的结构简式是__________。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A.X原子可能为第ⅤA族元素
B.Y原子一定为第ⅠA族元素
C.该分子中既含有极性共价键又含有非极性共价键
D.从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应2A![]() B+3C,在以下四种情况中处于平衡状态的是( )
B+3C,在以下四种情况中处于平衡状态的是( )
正反应速率 | 逆反应速率 | |
A | v(A)=2 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
B | v(A)=2 mol·L-1·min-1 | v(C)=2 mol·L-1·min-1 |
C | v(A)=1 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
D | v(A)=1 mol·L-1·min-1 | v(C)=1.5 mol·L-1·min-1 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(2014·安徽理综,11,6分)室温下,下列关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO![]() )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com