
科目: 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变ΔH>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0mL0.10 mol L–1氨水中滴入0.10 mol L–1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol L–1氨水的电离度为1.32%,下列有关叙述正确的是
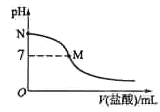
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】碱金属元素是周期性表现得最鲜明和最规律的一族元素。下列说法正确的是
A. 单质都能浮在水面上,都能保存在煤油中
B. 单质在空气中燃烧时,都生成氧化物
C. 单质都不能在自然界中稳定存在
D. 灼烧时均有颜色,焰色反应均应透过蓝色钴玻璃观察
查看答案和解析>>
科目: 来源: 题型:
【题目】等电子体之间具有相似的结构和化学键类型。根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是
A.CO32-和NO3- B.O3和SO2
C.CO2和NO2- D.SCN-和N3-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 2-甲基丁烷也称异丁烷
B. 由乙烯生成乙醇属于加成反应
C. C4H9Cl有3种同分异构体
D. 油脂和蛋白质都属于高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物在一定条件下既可以氧化成羧酸,又可以还原成醇,该酸和该醇可生成分子式为C4H8O2的酯,则下列说法错误的是( )
A.该有机物既有氧化性又有还原性
B.该有机物能发生银镜反应
C.将该有机物和分子式C4H8O2的酯组成混合物,只要总质量一定不论怎样调整二者的物质的量之比,完全燃烧时得到二氧化碳的量必定相等
D.该有机物是乙酸的同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G![]() B+H能放出大量的热,该反应曾应用于铁轨的焊接(G中元素A与元素B的质量比为3:7);
B+H能放出大量的热,该反应曾应用于铁轨的焊接(G中元素A与元素B的质量比为3:7);
②I是一种常见的温室气体,它和E可以发生反应:2E+I![]() 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。
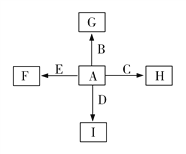
回答问题:
(1)①中反应的化学方程式为______________________;
(2)化合物I与过量氢氧化钠溶液反应的离子方程式_____________________;
(3)1.6 g G溶于盐酸,得到的溶液与铜粉完全反应,至少所需铜粉的质量为_____________;
(4)C与过量NaOH溶液反应的离子方程式为_________________________,反应后溶液与过量化合物I反应的离子方程式为________________________;
(5)E在I中燃烧观察到的现象是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
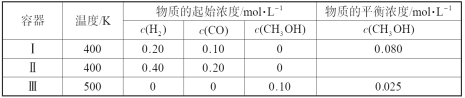
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目: 来源: 题型:
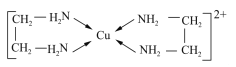
【题目】GaN、GaP、GaAs是人工合成的一系列新型半导体材料,其晶体结构均与金刚石相似。铜是重要的过渡元素,能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。回答下列问题:
(1)基态Ga原子价电子的轨道表达式为________________;
(2)熔点:GaN_____GaP(填“>”或“<”);
(3)第一电离能:As_____Se(填“>”或“<”);
(4)Cu2+与乙二胺所形成的配离子内部不含有的化学键类型是______;
a.配位键 b.极性键 c.离子键 d.非极性键
(5)乙二胺分子中氮原子轨道的杂化类型为________,乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是___________;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞边长为acm,铜原子的半径为rcm。该晶体中铜原子的堆积方式为_______型(填“A1”、“A2”或“A3”),该晶体密度为____g/cm3(用含a和NA的代数式表达),该晶体中铜原子的空间利用率为______(用含a和r的代数式表达)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com