
科目: 来源: 题型:
【题目】摩尔盐易[(NH4)2Fe(SO4)2]易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是______(利用简要文字和必要的离子方程式说明),配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和_______;
(2)“步骤2”中所用废铁屑必须过量,原因是______________;
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、______、过滤、洗涤、干燥;
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为___________;
② 产品中Fe2+的质量分数为_________;
③ 滴定过程中.左手控制________,右手摇动锥形瓶,直到_________时停止滴定,读数。此时若俯视读数.测定结果将偏________(填“高”或“低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中CO2浓度的持续走高引起人们的髙度重视。一些科学家认为,人类不仅要努力减少CO2的排放,还要尽快想办法清除空气中过多的CO2。为此,他们设想了一系列“捕捉” CO2的方法。
方法I :一些科学家利用太阳能加热的反应器“捕捉”空气中的CO2,如图1所示。
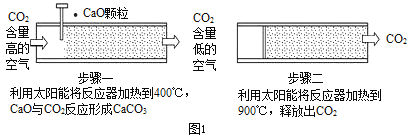
(1)太阳能加热的反应器是将_______能转化为________能。
(2)步骤二中发生反应的化学方程式是____________________ 。
方法II :另一些科学家利用NaOH溶液的喷淋“捕捉”空气中的CO2,如图2所示。
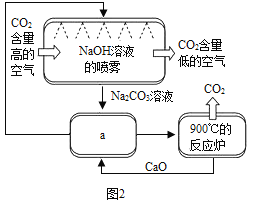
(3)NaOH溶液喷成雾状是为了_________,其中发生反应的化学方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另—份加入含bmolBaCl2的溶液;恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示

①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。
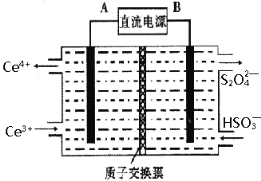
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表,回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;元素E在元素周期表中的位置是__________。
(2)写出A、B、C形成的化合物M的电子式________;B和C的离子中,半径较小的是______(填离子符号 );五种原子中半径最大的是________(填元素符号 )。五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)________________________________。
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________。
(4)D单质与M的水溶液反应的离子方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究。
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
M(OH)n | Ksp | pH | |
开始沉淀 | 沉淀完全 | ||
Al(OH)3 | 2.0×10-32 | 3.8 | —— |
Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
Fe(OH)2 | 8.0×10-16 | 6.95 | 9.95 |
Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
回答下列问题:
(1)该电池的负极材料是___________________,正极反应式为_________________,
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作__________min(小数点后保留2位)。(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是_____________。过滤,在滤液中慢慢加入NiO固体,则开始析出沉淀时的离子方程式是_______________和___________________。若将两种杂质阳离子都沉淀析出,pH应控制在___________(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_____________。
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4·2H2O和滤液A,A的主要成分是_____________;电解滤液A,在阴极产生气体B______(填分子式);在阳极产生气体C______(填分子式)。将NiC2O4·2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为______(填“B”、“C”)极气体,判断依据是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A. 化学研究的主要目的就是认识分子
B. 电解饱和食盐水制烧碱,用涂镍碳钢网作阳极
C. 化学家可以制造出自然界中不存在的物质
D. 《黄帝九鼎神丹经》中的“柔丹”是在土釜中加热Hg制得的。这里的“丹”是指硫化物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于 ①乙烯 ②苯 ③乙醇 ④乙酸 ⑤葡萄糖等有机物的叙述不正确的是
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤
B.只有①③⑤能使酸性KMnO4溶液褪色
C.只有②③④能发生取代反应
D.一定条件下,⑤可以转化为③
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的①CH4、②H2、③HC1、④SO2四种气体,在标准状况下体积由大到小的顺序是
A.②>①>③>④ B.④>③>①>② C.③>②>④>① D.①>④>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com