
科目: 来源: 题型:
【题目】下表列出了 AH八种元素在周期表中的位置。
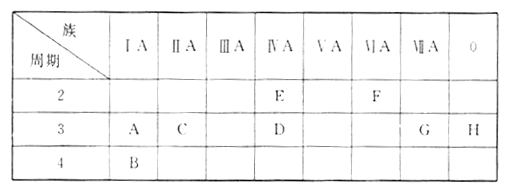
(1)这八种元素中化学性质最不活泼的是____________(填元素符号)。
(2)A、B、G 种元素对应的简单离子半径由大到小的顺序为______________(用离子符号表示)。
(3)F元素与氢元素能形成18电子的化合物,该化合物的化学式为_______________。 (4) C元素与G元素形成化合物的电子式是____________________。
(5)A、D两元素最高价氧化物对应的水化物之间发生反应的离子方程式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】偏钒酸铵(NH4VO3)主要用作催化剂、催干剂、媒染剂等。用沉淀法除去工业级偏钒酸铵中的杂质硅、磷的流程如下:

(1)碱溶时,下列措施有利于NH3逸出的是_____(填字母)。
A.升高温度 B.增大压吸 C.增大NaOH溶液的浓度
(2)①滤渣的主要成分为Mg3(PO4)2、MgSiO3,已知Ksp(MgSiO3)=2.4×l0-5.若滤液中c(SiO32-)=0.08mol/L,则c(Mg2+)=__________。
②由图可知,加入一定量的MgSO4溶液作沉淀剂时,随着温度的升高,除磷率下降,其原因是温度升高,Mg3(PO4)2溶解度增大和_______;但随着温度的升高,除硅率升高,其原因是______(用离子方程式表示)。

(3)沉钒时,反应温度需控制在50℃,在实验室可采取的加热方式为_______。
(4)探究NH4Cl的浓度对沉钒率的影响,设计实验步骤(常见试剂任选):取两份10mL一定浓度的滤液A和B,分别加入lmL和10mL的1mol/LNH4Cl溶液,再向A中加入_______mL蒸馏水,控制两份溶液温度均为50℃、pH均为8,由专用仪器洲定沉钒率。加入蒸馏水的目的是______。
(5)偏钒酸铵本身在水中的溶解度不大,但在草酸(H2C2O4)溶液中因发生氧化还原反应而溶解,同时生成络合物(NH4)2[(VO)2(C2O4)3],该反应的化学方程式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分类是学习和研究化学的一种的重要方法,下列分类合理的是( )
A.K2CO3和K2O都属于盐
B.H2SO4和HNO3都属于酸
C.KOH和Na2CO3都属于碱
D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】已知醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则下列说法正确的是( )
A. 实现该变化的只能是升高温度
B. 溶液的导电能力一定变强
C. 溶液的pH一定减小
D. 发生电离的分子总数增多
查看答案和解析>>
科目: 来源: 题型:
【题目】我国有广阔的海岸线,海水综合利用大有可为.海水中Br﹣含量为65mgL﹣1,从海水中提取溴的工业流程如下:
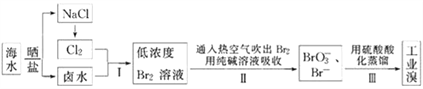
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:_______.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的___(填序号).
A.氧化性B.还原性C.挥发性D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
___Br2+ CO32﹣═ BrO3﹣+ Br﹣+ CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式:___________.
(5)实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是____(填序号).
A.乙醇B.四氯化碳C.裂化汽油 D.苯
(6)用上述流程制得含Br265%的工业溴1t,至少需要海水_____m3.
(7)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式:__________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是
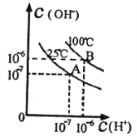
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2 溶液和0.2 mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2 mol/L NaOH溶液与 0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH大于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH小于7
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学要配制100mL0.100 mol/ LNa2CO3溶液。下图是一些关键步骤和操作。
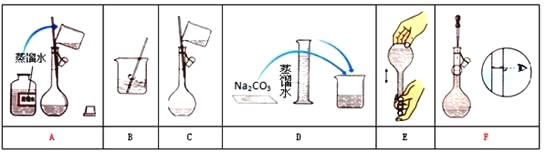
(1) 配制过程的先后顺序为(用字母A-F填写)_____________。
(2) 配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、__________。
(3) 若用Na2CO3·10H2O晶体来配制溶液,但晶体己经部分失去结晶水,则所配得溶液的浓度会____________ (填“偏高”、“偏低”、“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。

据如图回答:
(1)甲同学设计实验的依据是____________________________________。
(2)写出选用的化学试剂:B____________,其作用为___________。
(3)C中反应的离子方程式为____________________________________________。
据如图回答:
乙同学的实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后CCl4层溶液变为紫红色。
(4)写出B处反应的离子方程式 ___________________________________________。
(5)A中验证氯气的氧化性强于碘的实验现象是_____________________。
(6)过程Ⅲ实验的目的是_________________________。
(7)综合甲、乙两同学的实验得出的结论是:同主族元素从上到下元素的非金属逐渐减弱,其原因是___________________________________________(试从原子结构角度解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图: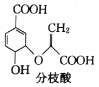 下列关于分枝酸的叙述正确的是( )
下列关于分枝酸的叙述正确的是( )
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.分枝酸最多可与3mol NaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com