
科目: 来源: 题型:
【题目】室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法正确的是
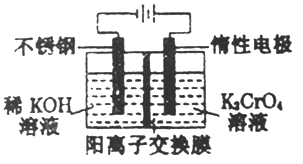
A. 在阳极室,通电后溶液逐渐由橙色变为黄色
B. 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g
C. 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA
D. 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
查看答案和解析>>
科目: 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
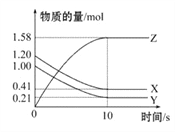
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 10 s后,该反应停止进行
C. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 0~10 s的时间内的平均反应速率:v(X)=v(Y)=0.0395 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是

A.向饱和Ag2CrO4溶液中加入固体K2CrO4能使溶液由Y点变为X点
B.T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
C.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
D.图中a=![]() ×10-4
×10-4
查看答案和解析>>
科目: 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生成锂离子电池。下列说法正确的是
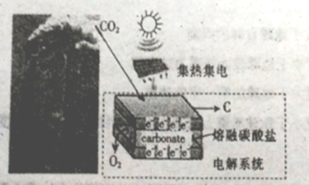
A. 图中能量转化方式只有一种
B. 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑
C. 若反应中转移1mole-,则理论上消耗CO32-0.5mol
D. 当生成12g碳材料时,可收集到22.4LO2
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是( )

A. 原子半径:W B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用中和滴定法测定某烧碱的纯度,实验过程如下:
(1) 配制待测液:称取6.0 g固体烧碱样品(杂质不与酸反应)配制成250 mL溶液。
(2) 滴定:
①用_______量取15.00 ml.待测液。
②向锥形瓶中加入几滴甲基橙,用0.2010 mol L-1的标准硫酸滴定待测烧碱溶液,边滴边摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化,滴定终点时的现象为________________。
(3)数据处理
实验次 序编号 | 硫酸溶液体积 V/mL | 氢氧化钠溶液体积 V/mL |
1 | 19.90 | 15.00 |
2 | 20.10 | 15.00 |
3 | 22.00 | 15.00 |
4 | 20.00 | 15.00 |
根据上述表格,选取合适的数据,计算待测烧碱溶液的浓度为______________,碱的纯度为_______________(保留两位小数)。
(4)—定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。某研究性学习小组在实验室中配制盐酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是
__________________(多选)
A.实验中所用到的滴定管、容量瓶,在使用前均需要验漏
B.如果实验中需用80 mL的稀盐酸标准溶液,配制时应选用100mL容量瓶
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀盐酸,则测得的NaOH溶液的浓度将偏小
E.配制标准溶液时,定容时俯视读数,则导致滴定时测得的NaOH溶液的浓度偏大
F.中和滴定时,若在最后一次读数时俯视读数,则导致实验结果偏小
G.锥形瓶用蒸馏水洗浄后,有少量蒸馏水残留,则导致实验结果偏小
H.滴定前滴定管尖嘴有气泡,滴定后气泡消失,则导致实验结果偏大
I.在滴定过程中,不慎将数滴酸液滴在锥形瓶外,则导致实验结果偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】按题目要求答题:
(1)CH3CH2C(CH3)2CH(C2H5)CH3的系统命名是___________________;
(2)写出甲苯与浓硫酸、浓硝酸的混合酸在100℃发生取代反应的化学方程式:_______________;
(3)写出下列各有机物的结构简式
①支链只有一个乙基且式量最小的烷烃____________________;
②某烃类化合物A的相对分子质量为84,能与氢气发生加成反应。A的一氯取代产物只有一种,则A的结构简式为 ;
③二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效,具有优良的环保性能。写出与二甲醚相对分子质量相等且元素种类相同的所有有机物的结构简式是:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是 (用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-) (填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)= mol/L, c(OH-)- c(HA)= mol/L
(4)常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH 7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH 7(填“大于”、“等于”或“小于”);将同温度下等浓度的下列四种盐溶液按PH由大到小的顺序排列是 (填序号)
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com