
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素,用化学符号回答下列问题。
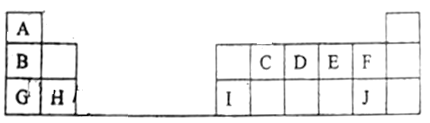
(1)元素J在周期表中的位置是____________。
(2)元素G和元素I对应的最高价氧化物的水化物之间能发生化学反应,试写出该反应的离子方程式____________。
(3)在A~J中,原子半径最大的是_______,最活泼的非金属是_______,最高价氧化物的水化物中酸性最强的是_______。
(4)在G和H中化学性质比较活泼的是_______,请设计化学实验加以证明_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1 000 mL,其pH与溶液体积的关系如图19,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】水中的溶解氧的含量是衡量水质的一个重要指标,某实验兴趣小组通过如下步骤来测量水中溶解氧的含量:
步骤一:向溶解氧测量瓶中注入20.00 mL水样,再分别加入1 mL 0.1 mol L-1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应。此时发生反应的化学方程式为: Mn2++2OH-=Mn(OH)2↓ 2Mn(OH)2+ O2 =2MnO(OH)2
步骤二:向上述混合物中加入1.5 mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色。
步骤三:将溶液全部转移到容量瓶中,向其中滴加23滴淀粉溶液,溶液呈蓝色。用 0.005 mol L-1的Na2S2O3标准溶液滴定至蓝色恰好消失,共消耗Na2S2O3标准溶液3.60 mL。此时发生反应为:
I2+2Na2S2O3= 2NaI + Na2S4O6
(1)25 ℃时,步骤一中当加入NaOH使溶液的pH = 12时,此时溶液中的c(Mn2+)=_________mol L-1 。 (已知 KspMn(OH)2 =2.06×10-13)
(2)写出步骤二中所发生反应的化学方程式:______________________________。
(3)计算该水样中溶解氧的含量。(单位:mg L-1,请写出计算过程)______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
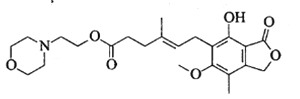
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
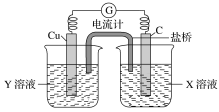
①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】12mL浓度为0.05mol/L 的Na2SO3溶液恰好与VmL浓度为0.02mol/L的K2X2O7溶液完全反应。已知X元素在产物中的化合价为+3。则V为( )
A. 5 B. 10 C. 15 D. 20
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向饱和AgCl溶液中加水,下列叙述正确的是
A. AgCl的溶解度增大 B. AgCl的溶解度、Ksp均不变
C. AgCl的Ksp增大 D. AgCl的溶解度、Ksp均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中需要2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl质量分别是( )
A. 950mL,111.2g B. 950mL,117.0g
C. 1000mL,117.0g D. 1000mL,111.2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com