
科目: 来源: 题型:
【题目】某集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,其反应式可表示为2H2O ![]() 2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④ 该过程将光能转化为化学能。以上叙述中正确的是
2H2↑+O2↑。有下列几种说法:①水的分解反应是放热反应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④ 该过程将光能转化为化学能。以上叙述中正确的是
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】(Ⅰ)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL/SPT) | 50 | 120 | 232 | 290 | 310 |
(1)上述时间段中(填0~1、1~2、2~3、3~4、4~5 min)反应速率最大的是
_____________min,其主要原因是_____________。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率__________________ 。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是(填编号) __________ 。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
(Ⅱ)某同学做同周期元素性质递变规律实验时,自己设计了—套实验方案,并记录了有关实验现象如下表(表中的“实验方案”与“实验现象”前后不—定是对应关系)
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色。 |
②钠与滴有酚酞试液的冷水反应 | B.有气体产生,产生的气体可在空气中燃烧,溶液变成浅红色。 |
③镁带与2mol/L盐酸反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧。 |
④铝条与2mol/L盐酸反应 | D.生成白色胶状沉淀,继而沉淀消失。 |
⑤向氯化铝溶液中滴加氢氧化钠溶液至过量 | E.剧烈反应,产生的气体可以在空气中燃烧。 |
请你帮助该同学整理并完成实验报告
(1)实验目的:_________________。
(2)实验用品:仪器:①砂纸,②试管,③胶头滴管,④酒精灯,⑤试管夹、试管架,⑥滤纸,⑦镊子,⑧小刀,⑨玻璃片,⑩锥形瓶(100mL)等;
药品:钠、镁条、铝条、2mol/L,的盐酸、AlCl3溶液、氢氧化钠溶液等。
(3)填写与实验方案相对应的实验现象(从上表“实验现象”中选择),并完成有关离子方程式
实验方案 | 实验现象(填写字母代号) | 有关离子方程式 |
① | _________ | Mg+2H2O(热水)==Mg(OH)2+H2↑ |
② | _________ | _____________________ |
③ | _________ | Mg+2H+==Mg2++H2↑ |
④ | _________ | ___________________ |
⑤ | _________ | Al3+ + 3OH- = Al(OH)3↓ |
___________________ |
(4)实验结论:_____________________
(5)该同学在本实验④中用去m克纯固体,反应完毕后无固体剩余,共收集到VL气体(SPT)下,该同学欲求此固体的原子量的表达式为________(用含m和V的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
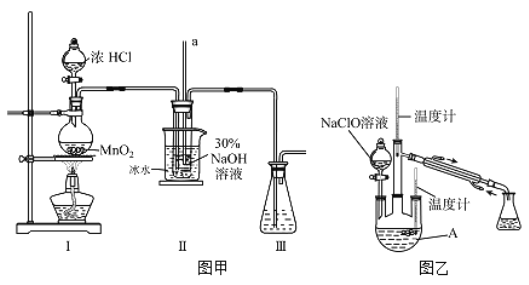
(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③盛放待测盐酸的锥形瓶内有少量蒸馏水;④酸式滴定管用蒸馏水洗后,未用待测液润洗;⑤读取碱式滴定管终点读数时,俯视刻度线。
A. ①②③ B. ②④⑤ C. ③④⑤ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 空气中加热钠生成淡黄色固体:2Na +O2![]() Na2O2
Na2O2
B. 铁与水蒸气反应生成黑色固体:3Fe +4H2O(g) ![]() Fe3O4 +4H2
Fe3O4 +4H2
C. 除去乙炔中的H2S气体:H2S +Cu2+= CuS↓+2H+
D. 实验室制备氨气:NH4 Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在标号元素中,最活泼的金属元素是____。最活泼的非金属元素是____。(写元素符号)⑨元素的离子结构示意图是____________________。
(2)①与②形成共价化合物的电子式________________。用电子式表示⑤与⑨形成化合物的形成过程__________________________________________。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是________。(写元素符号)
(4)⑦、⑧、⑨三种元素所形成的气态氢化物中,最稳定的氢化物是____(写分子式);其三种元素的最高价含氧酸的酸性由强到弱的顺序 _________。(写酸的分子式)
(5)写出⑥元素的单质与氢氧化钠反应的离子方程式:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温、恒容条件下,不能表示H2(g)+I2(g) ![]() 2HI(g)达到化学平衡状态的是( )
2HI(g)达到化学平衡状态的是( )
A. 单位时间内消耗a mol H2的同时消耗2a mol HI
B. 容器内的总压强不随时间变化
C. 容器内H2、I2不再减少,HI不再增加
D. 混合气体的颜色不再发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. 平衡移动,K值可能不变 B. 平衡移动,K值一定变化
C. K值不变,平衡可能移动 D. K值变化,平衡一定移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质按酸、碱、混合物、电解质的顺序组合的一组是
A. 氢氟酸、纯碱、空气、液氨
B. 硝酸、烧碱、水玻璃、硫酸钡
C. 醋酸、熟石灰,胆矾、小苏打
D. 硫酸、碱式碳酸铜、汽油、草木灰
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如右图所示,对该反应的推断合理的是( )
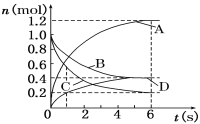
A.该反应的化学方程式为3B+4D ![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com