
科目: 来源: 题型:
【题目】
铁和铜都是生产、生活中应用广泛的金属,能形成很多种合金和化合物。请回答:
(1)基态Cu+的价层电子排布图为________。基态Fe3+中有________种运动状态不同的电子。
(2)铁单质能形成Fe(CO)5,其熔点为-21℃,沸点为102.8℃。则Fe(CO)5晶体的类型为________,其σ键和π键的数目之比为________。与CO互为等电子体的离子符号为________(任写一种)。
(3)铜元素的焰色反应呈绿色,很多金属元素能发生焰色反应的微观原因为________。
(4)[Cu(NH3)4]SO4中,所含基态非金属原子的第一电离能由小到大的顺序为________。阴离子的空间构型为________,其中心原子的杂化轨道类型为________。
(5)铁单质的一种晶体的堆积模型为体心立方堆积,晶胞参数为apm;铜单质的一种晶体的堆积模型为面心立方最密堆积,晶胞参数为bpm。则两种晶体中,铁原子和铜原子的配位数之比为________,晶体的密度之比为________(用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙苯(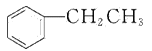 )在有机合成中占有重要的地位,有着广泛的用途。
)在有机合成中占有重要的地位,有着广泛的用途。
已知:
①![]() ΔH1=-54kJ·mol-1。
ΔH1=-54kJ·mol-1。
②![]() ΔH2=-121kJ·mol-1。
ΔH2=-121kJ·mol-1。
③H2(g)+Cl2(g)=2HCl(g) ΔH3=-185kJ·mol-1。
④相关化学键的键能数据如表所示。
化学键 | C—H | C—C | C=C | C—Cl | H—Cl |
键能/(kJ·mol-1) | 412 | 348 | x | 341 | 432 |
请回答:
(1)根据化学反应原理,缩小容器容积对反应②的影响为________。
(2)根据反应①和表中数据计算,x=________。
(3)![]()
①ΔH4=________。
②该反应正、逆反应平衡常数与温度的关系如图所示,其中表示正反应平衡常数K正的曲线为________(填“A”或“B”),理由为________。
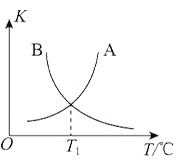
④T1℃时,该反应的平衡常数K=________。该温度下,起始向容积为10L的容积可变的密闭容器中充入1mol![]() (g)、2molCl2(g)、1mol
(g)、2molCl2(g)、1mol![]() (g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
(g)、2molHCl(g),则开始时,v正________(填“>”“<”或“=”)v逆。
查看答案和解析>>
科目: 来源: 题型:
【题目】升高温度时,化学反应速率加快,主要是由于
A. 分子运动速率加快,使反应物分子间的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C. 该化学反应的过程是放热的
D. 该化学反应的过程是吸热的
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A. 2.24LCO2中含有的原子数为0.3 ×6.02×1023
B. 0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D. 4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com