
科目: 来源: 题型:
【题目】I.人们应用原电池原理制作了多种电池,以满足不同的需要,广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极电极反应式为_________。电池工作一段时间后需要充电,充电过程中电池液中H2SO4的浓度_____(填“增大”、“减小”或“不变”)。
⑵某学习小组依据氧化还原反应:2Ag++Cu===Cu2++2Ag设计成原电池,则负极发生的电极反应为___________;当反应进行到一段时间后取出电极材料,测得某一电极增重了 5.4g,则该原电池反应共转移了的电子数目是________________________。
⑶燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
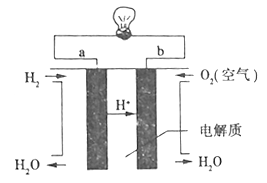
①该电池的正极反应式_________________。
②若该电池的效率80%,当外电路通过0.2mo1电子时,消耗O2的体积____L(标准状况)
II.用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应4HC1+O2 ![]() 2Cl2+2H2O,可实现氯的循环利用。己知上述反应中,4mol HC1被氧化,放出约116kJ的热量。
2Cl2+2H2O,可实现氯的循环利用。己知上述反应中,4mol HC1被氧化,放出约116kJ的热量。
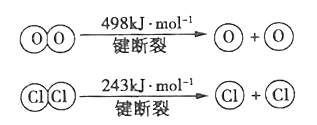
计算断开1 mol H-O键与断开1 mol H-C1键断所吸收能量相差约为______kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.控制变量法是化学实验中的—种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点—位),分析以下数据,回答下列问题:
序号 | 硫酸的体积 /mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的 时间/s | 生成硫酸锌的质量/g |
① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | 19.3 |
(1)实验①和实验②表明_____对反应速率有影响;研究锌的形状对反应速率的影响时,最好选取实验_______ (填3个实验序号)。
(2)下列数据推断正确的是______________________。
A. t1<70 B.t1>t4 C.m12 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是___________________________________。
(4)根据表中数据计算:硫酸的物质的量浓度是_________________mol/L。
II.己知在 25℃、l0l kPa 下,2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
N2(g)+2CO2(g),现将 2molNO、2.4molCO通入恒容密闭容器中,反应过程中部分物质的浓度变化如图所示。
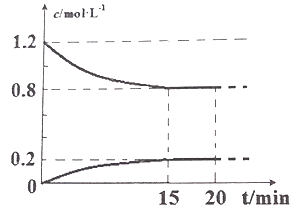
(1) 015min 内,v(CO2) =__________________。
(2)该反应的速率时间图像如下图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图像如下图中右图所示。以下说法正确的是______(填对应字母)。
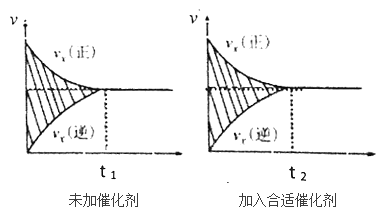
A.a1>a2 B.b12 C.t1>t2
(3) 一定条件下,己知反应NO2(g)+SO2(g) ![]() NO(g)+SO3(g),将NO2
NO(g)+SO3(g),将NO2
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO2与SO2的体积比保持不变 d.每消耗lmol SO2的同时生成lmol NO
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息,回答下列问题:
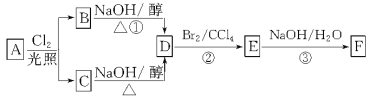
A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。A的分子式是_______。
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为_________________。
(3)D的结构简式________________,D中碳原子是否都处于同一平面?________。
(4)E的同分异构体的结构简式是___________________________。
(5)①、②、③的反应类型依次是_________________________。
(6)写出②、③的反应化学方程式_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色透明溶液中,下列离子一定能共存的是( )
A.H+ Cu2+ Cl﹣ SO42﹣
B.HCO3﹣ NO3﹣ Na+ H+
C.SO42﹣ Cl﹣Na+ K+
D.Na+SO42﹣H+ AlO2﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关金属铝及其化合物的叙述正确的是( )
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.氧化铝只能与酸反应,不能与碱反应
D.铝既能溶于酸,又能溶于强碱
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质的分类合理的是
A.碱性氧化物:Na2O、CaO、Mn2O7、Na2O2
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.氧化物:CO2、NO、SO2、H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】化学无处不在,下列与化学有关的说法正确的是( )
A. 液氨汽化时能吸收大量的热,故可用作制冷剂
B. SO2能漂白纸浆等,故可广泛用于食品的漂白
C. 味精的主要成分是蛋白质,烧菜时可加入适量
D. 氢氟酸可用于雕刻玻璃制品,这是利用酸的通性
查看答案和解析>>
科目: 来源: 题型:
【题目】以某含铜矿石[主要成分为FeCu4SiO5(OH)4,含少量SiO2、CuCO3]为原料,制备CuSO4·5H2O的流程如下:
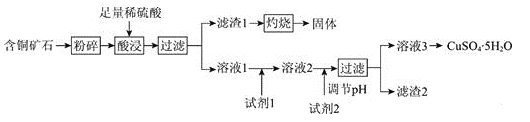
已知:
ⅰ.溶液中离子浓度小于等于1.0×10-5mol·L-1时,认为该离子沉淀完全。
ⅱ.相关试剂成分和价格如表1所示。
ⅲ.25℃时,该流程中金属离子生成氢氧化物时,开始沉淀和沉淀完全的pH如表2所示。
表1
试剂 | 成分 | 价格/(元·吨-1) |
漂白液 | 含25.2%NaClO | 450 |
双氧水 | 含30%H2O2 | 2400 |
浓硝酸 | 含98%HNO3 | 1500 |
表2
氢氧化物 | 开始沉淀的pH | 沉淀完全的pH |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.0 | 6.5 |
请回答:
(1)FeCu4SiO5(OH)4用氧化物的形式可表示为________。
(2)结合题中信息,所选用的试剂1的名称为________;加入该试剂时,所发生反应的离子方程式为________。
(3)加入试剂2,需调节溶液的pH的合理范围为________。试剂2可以选择下列物质中的________(填字母)。
A.Cu B.CuO
C.Cu(OH)2 D.Fe
(4)25℃时,Cu(OH)2的溶度积常数Ksp[Cu(OH)2]=________。
(5)CuSO4·5H2O溶液可用于电解精炼铜。电解精炼铜时,导线中通过9.632×104C的电量时,理论上阴极质量增加________g。(已知:1个电子的电量为1.6×10-19C)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com