
科目: 来源: 题型:
【题目】现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中氢氧根离子浓度________(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式________________;所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因______________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol·L-1,则c(SO42-)=________;
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是
A. MgO固体(Al2O3) B. Na2CO3固体(NaHCO3)
C. FeCl2溶液(CuCl2) D. Fe2O3固体(SiO2)
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是镁的主要来源之一。从海水中提取镁可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。
(1)以上提取镁的全过程中,没有涉及的化学反应类型是 (填序号)。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)下列关于提取镁的说法中不正确的是 (填序号)。
A.此法的优点之一是原料来自大海
B.进行①②③步骤的目的是富集MgCl2
C.可用电解熔融氧化镁的方法制取镁
D.电解冶炼镁要消耗大量电能
(3)电解熔融氯化镁制取镁的化学反应方程式 。
(4)③中沉淀物与盐酸反应的离子反应方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)可用于制造生物碱、油墨、化肥、钼红颜料、催化剂等,也可用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)Na2MoO4中Mo的化合价为____________。
(2)“焙烧”时,Mo元素转化为MoO3,反应的化学方程式为____________,氧化产物是________(写化学式)。
(3)“碱浸”生成CO2和另外一种物质,CO2的电子式为_______,另外一种生成物的化学式为______。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,SO42-的去除率为______%。(小数点后保留一位数字)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A 、B 、C 、D四种元素都为短周期元素,原子序数依次增大,A元素原子最外层电子数是其内层电子数的3倍, B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有14个中子的金属,当1.8克C与足量B的最高价氧化物对应水化物反应时,在标准状况下放出气体2.24L ,D的M层上7个电子。
(1)写出各元素名称:A____,B_____,C_____,D_____;
其中D在周期表中的位置:___________________。
(2)B的离子结构示意图:______________ 。
(3)分别写出B和D的最高价氧化物的水化物的化学式______,_______.
(4)比较D的气态氢化物与H2S和HF的稳定性: ___________________(由强到弱排列)。
(5)写出B与C 的最高价氧化物对应水化物之间发生反应的离子方程式:______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1molN2和3molH2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
2NH3(g) △H=-92.4kJ/mol。当反应达到平衡时,N2和H2的浓度之比是_______;当升高平衡体系的温度,则混合气体的平均式量______(将“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1mol N2,H2的转化率_______(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡_______移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为________,其溶于水能_____水的电离(填“促进”或“抑制”),且使溶液的pH_______(填“升高”“降低”或“不变”),原因是_________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2![]() 4NO+6H2O(g) △H=-905kJ/mol ①
4NO+6H2O(g) △H=-905kJ/mol ①
4NH3(g)+3O2![]() 2N2+6H2O(g) △H=-1268kJ/mol ②
2N2+6H2O(g) △H=-1268kJ/mol ②
①氮气与氧气反应生成NO的热化学方程式为______________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是_____。
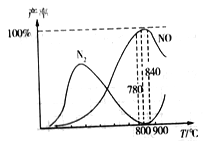
A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840℃之间
B.工业上采用物料比![]() 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1molM在氧气中完全燃烧,只生成1molCO2和2molH2O,则M的化学式为_______。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1molM,则电路中通过_____mol电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.6.02×1023个SO2分子的质量为64g
D.标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活息息相关,下列叙述错误的是( )
A. 光催化还原水制氢比电解水制氢更节能环保、更经济
B. 铁表面镀锌可增强其抗腐蚀性
C. 用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D. 制饭勺、饭盒、高压锅等的不锈钢是合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com