
科目: 来源: 题型:
【题目】回答下列问题:
(1)写出泡沫灭火器的灭火原理的离子方程式
(2)已知25℃,101 kPa时:
S(s)+O2(g)==SO2(g) H=-296.8 kJ/mol
2Cu(s)+O2(g)==2CuO(s) H=-314.6 kJ/mol
Cu(s)+S(s)==CuS(s) H=-53.1 kJ/mol
写出CuS(s)与O2(g)反应生成CuO(s)和SO2(g)的热化学方程式 。
(3)已知常温下AI(OH)3的Ksp=l.0×10-33,若溶液中c(Al3+)为1.0 mol/L,请计算Al3+开始沉淀的pH= 。常温下,浓度均为0.01mol/L的CH3COOH和CH3COONa的混合液中,PH = a,则醋酸的电离常数约为Ka = 。
(4)在常温下,向V L pH=12的Ba(OH)2溶液中逐滴加入一定浓度的NaHSO4稀溶液,当溶液中的Ba2+ 恰好沉淀完全时,溶液pH=11。则Ba(OH)2溶液与NaHSO4溶液的体积比为 ,NaHSO4溶液的物质的量浓度为 mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) ![]() Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
A. 混合气体的密度不再变化 B. 反应容器中Y的质量分数不变
C. X的分解速率与Y的消耗速率相等 D. 单位时间内生成1 mol Y的同时生成2 mol X
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积为1.0 L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) 下列说法正确的是
CH3OCH3(g)+H2O(g) 下列说法正确的是
编号 | 温度 | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
Ⅰ | 387℃ | 0.20 | 0.080 | 0.080 |
Ⅱ | 387℃ | 0.40 | ||
Ⅲ | 207℃ | 0.20 | 0.090 | 0.090 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C. 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D. 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol和H2O 0.10 mol,则反应将向正反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如下表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料。
M | |
T |
请回答下列问题:
(1)T离子的结构示意图为__________,元素W在周期表中位于第______族,M单质分子的电子式为__________。
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶盛放氢氧化钠溶液的原因是(用化学方程式表示)__________。
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)__________。
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可用于工业炼铁。制备RW4的化学方程式为______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年11月5 日,长征三号乙运载火箭将两颗北斗三号全球导航卫星送入太空轨道。下列有关说法正确的是
A. 火箭燃料中的四氧化二氮属于化石燃料 B. 火箭燃料燃烧时将化学能转化为热能
C. 火箭箭体采用铝合金是为了美观耐用 D. 卫星计算机芯片使用高纯度的二氧化硅
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥气体
B. ClO2具有强氧化性,可用于消毒杀菌
C. 铝具有良好导热性,可用铝罐贮运浓硝酸
D. FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年10月,我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢靑蒿素而获得2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学奖的华人女科学家,震惊世界,感动中国。青蒿素(C15H22O5)的结构如图甲所示。请回答下列问题:
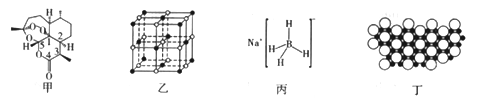
(1)组成靑蒿素的三种元素电负性由大到小的顺序是_________;在基态O原子中,核外存在________对自旋方向相反的电子。
(2)下列关于青蒿素的说法正确的是_______(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为4NaH+ B(OCH3)3![]() NaBH4+3CH3ONa。
NaBH4+3CH3ONa。
①NaH为______晶体,图乙是NaH晶胞结构,则NaH晶体的配位数是______;若晶胞棱长为a,则Na原子间最小核间距为_______。
②B(OCH3)3中B采用的杂化类型是__________。写出一种与B(OCH3)3具有相同空间构型的分子或离子:______________________。
③NaBH4结构如图丙所示,结构中存在的作用力有__________。NaBH4是有机化学中的一种常用还原剂,其在热水中水解生成偏硼酸钠和氢气,该反应的化学方程式为______________。
(4)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同—平面上。根据图示确定硼化镁的化学式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取NH3的气体发生装置,请结合所学知识,回答下列问题:
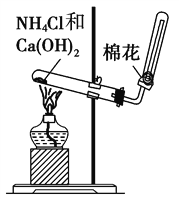
(1)图中用于加热的仪器名称是__________,收集的方法是________________法,验证是否已经收集满的方法是______________________________(任写一种)。
(2)写出实验室制取NH3的化学方程式:________________________________________。
(3)若有5.35 g氯化铵参加反应,则产生的在标准状况下的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。并能以它们为原料生产一系列化工产品。为提高原料的利用率,节能降耗。设计如图所示工艺流程,其中氯碱工业装置中的电极未标出。
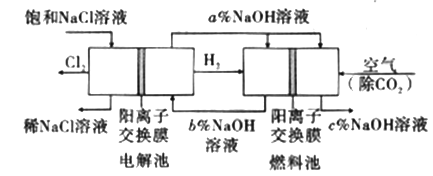
(1)电解饱和食盐水的化学方程式为___________________。
(2)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,正确的操作步骤的顺序是_______ (填序号)。
①过滤②加过量NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
(3)图中NaOH溶液的质量分数a%、b%、c%,由大到小的顺序为_________。
(4)氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol/L的四种钠盐溶液pH如下表,下列说法不正确的是_______(填序号)。
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
A.向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是HClO
D.四种盐的阴离子结合H+能力最强的是HCO3-
(5)若利用电解氯化钠溶液所得的气体制36.5%的浓盐酸100t,最少需要消耗食盐_________t。
(6)氯碱工业产品Cl2可用于冶炼钛铁矿得到金属钛,流程如图。写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
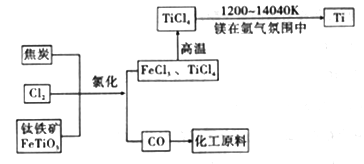
(7)氮气和氩气是两种化学性质相对稳定的气体。镁还原TiCl4的反应中为防止Mg和Ti被氧化选择稀有气体氩气。试用化学反应方程式解释不选用氮气的原因:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com