
科目: 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中氧化产物与还原产物的物质的量之比为 A
A.5∶3 B.5∶4 C.1∶1 D.3∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】关于水和无机盐的叙述,不正确的是
A. 极性分子或离子易溶于水,水是生物体内物质运输的良好介质
B. 多细胞生物体的绝大多数細胞,必须浸润在以水为基础的液体环境中
C. 无机盐在生物体内含量不高,多数以离子形式存在
D. 维持血浆的正常浓度、酸碱平衡等需要保持恒定的无机盐浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于淀粉、脂肪、蛋白质和核酸的叙述,正确的是
A. 都普遍存在于动植物细胞中
B. 都含有C、H、O、N等元素
C. 合成过程中都需要水
D. 等质量的脂肪氧化分解释放的能量比淀粉多
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)一定条件下,某烷烃的密度是氢气密度的64倍,它有多种结构,写出其一氯代物有两种结构的该烷烃的结构简式___________。
(2)20mL某烃在80mL氧气中充分燃烧,反应后恢复至室温,混合气体体积变为50mL,则该烃的分子式为_______。
A.CH4 B.C3H6 C.C3H4 D.C2H6
(3)写出下列有机方程式:
①HOCH2CH2OH的催化氧化:__________。
②HOOCCOOH与HO CH2CH2OH酯化成环:____________。
③已知![]() +║→
+║→![]() 则,
则,![]() +
+![]() →___________。
→___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是
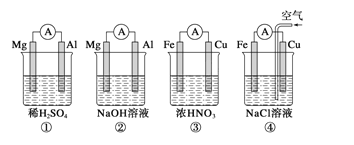
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业上用氨催化氧化制硝酸。
(1)由氨氧化制备硝酸的第一步反应的化学方程式:______________
(2)由于二氧化氮不能被水完全吸收,因此生成的气体须经过多次氧化、吸收的循环操作,使其充分转化为硝酸(如果不考虑生产过程中的其它损失).
①从理论上分析,要使氨气完全转化为硝酸,则原料氨气和氧气物质的量的投料比至少为____.
②如果按理论上的原料比将原料放在一个具有反应条件的密闭容器中进行,所有物质不与外界交换,则最后所得溶液的质量分数为______.
Ⅱ.某学习小组为了模拟工业上氨氧化制硝酸,用下列仪器进行实验:
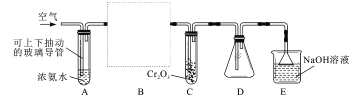
C装置可以加热,回答下列问题:
(3)装置图中虚线方框内必要仪器的名称和所盛试剂分别为_________
(4)A处的玻璃导管设置成可上下抽动的原因__________________
(5)实验中在D中观察到的实验现象是____________
(6)E的作用是___________,E中倒置漏斗可防倒吸,能防倒吸的原因是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是
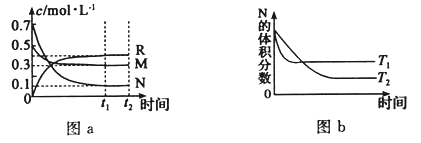
A.该反应的热化学方程式M(g)+3N(g)![]() 2R(g)△H>0
2R(g)△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
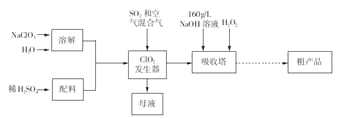
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化合物或结构的组成中,其元素组成不相同的是
A. 白细胞介素、胰岛素、生长激素 B. 核糖体、染色体、目的基因的运载体
C. 脂肪酸、丙酮酸、核苷酸 D. 抗体、膜上载体、蛋白酶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com