
科目: 来源: 题型:
【题目】I. 下面列出了几组物质,请将物质的合适序号填写在空格上。
同位素___________;同系物____________;同分异构体___________。
①金刚石与石墨; ②D与T; ③12C和13C; ④O2与O3;
⑤CH4和CH3CH2CH3; ⑥CH2=CHCH3和CH2=CH2;
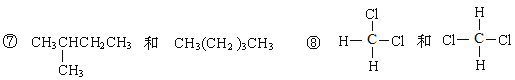
II.篮烷分子的键线式如图所示,试回答:
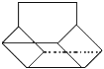
写出篮烷分子的化学式____________;篮烷分子的一氯取代物的种数为_______种。
III.在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)![]() N2O4(g) ,如图所示。
N2O4(g) ,如图所示。
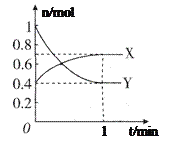
(1)曲线_____________ (填“X”或“Y”)表示NO2的物质的量随时间的变化曲线。
(2)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=18 mol/(L·min),乙中v(N2O4)=0.2 mol/(L·s),则______________中反应更快。
(3)在0到1 min中内用X表示该反应的速率是________,该反应达限度时,Y的转化率是_________,反应开始时与反应达平衡状态时的压强之比为______。
(4)若反应达平衡状态时再升高温度,容器内混合气体颜色加深,则正反应是_________反应(填“放热”或“吸热”。已知:降温有利于放热反应进行)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国目前大多数工厂以铬铁矿(主要成份为 FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。 步骤①中涉及的主要反应是:
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。
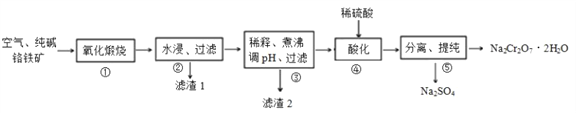
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为 ______, 氧化煅烧时将铬铁矿粉碎的目的是 ____________。
(2)①中杂质 Al2O3 与纯碱反应转变为可溶性盐,写出 Al2O3与纯碱反应的化学方程式________,滤渣1的主要成分为MgO和_______( 填化学式) 。
(3)滤渣2的成分是___________( 填化学式) 。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,发生反应的离子方程式为__________。
(5)该工艺的酸性废液中含有Cr2O72-,向废液中加入绿矾(FeSO4·7H2O)还原处理,反应的离子方程式是__________; 再向处理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L, 此时溶液的pH值为 ______(已知:该条件下,Ksp[Cr(OH)3]=1.0×10-32)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.2 g D![]() O中含有的质子数、中子数、电子数均为NA
O中含有的质子数、中子数、电子数均为NA
B.80 g CuO和Cu2S的混合物中含有的铜原子数一定为NA
C.标准状况下,5.6 L O2作氧化剂时转移电子数一定为NA
D.500 mL 2 mol·L-1 Na2CO3溶液中含C微粒总数一定为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )

A. 只采用升温的方式,可由a点变成d点
B. T<25
C. b点和c点pH均为6,溶液呈酸性
D. 两条曲线上任意点均有c (H+) ×c (OH-)=Kw
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下的密闭容器中,进行反应:2SO2 (g) + O2(g) ![]() 2SO3 (g)。下列有关说法正确的是
2SO3 (g)。下列有关说法正确的是
A. 催化剂的使用可实现SO2的转化率为100%
B. 其他条件不变,升高温度,不能增大反应的速率
C. 达到化学平衡时,各物质的浓度不再改变
D. 其他条件不变,降低SO3的浓度,可以增大反应的速率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中错误的是
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)42+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目: 来源: 题型:
【题目】I.计算以下数值(均为25℃时)
(1)某浓度的NH3·H2O溶液中,由水电离的c(H+)=1×10-12mol/L,该溶液的 pH=_________
(2)将pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,则H2SO4 溶液与NaOH溶液的体积比为______________
(3)向0.02mol/L的MgCl2溶液中加入NaOH固体,若要生成Mg(OH)2沉淀,溶液的pH最低为__________(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
II.(1)盐碱地因含较多的![]() ,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式_______________________________
,使得土壤呈碱性,不利于作物生长,通过施加适量石膏粉末(主要含有CaSO4,微溶于水)来降低土壤的碱性。写出该过程中发生反应的化学方程式_______________________________
(2)![]() 是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将
是一种无色或淡黄色液体,遇水剧烈反应得到二氧化硫和氯化氢,是一种常用的脱水剂。将![]() 与
与![]() 混合并加热,可得到无水
混合并加热,可得到无水![]() ,得到无水
,得到无水![]() 的化学方程式为______________________________
的化学方程式为______________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g) + O2(g) ![]() 2NO(g) ΔH = +183 kJ/mol
2NO(g) ΔH = +183 kJ/mol
2H2(g) + O2(g) === 2H2O(l) ΔH = -571.6 kJ/mol
4NH3(g) + 5O2(g) === 4NO(g) +6H2O(l) ΔH = -1164.4 kJ/mol
则 N2(g) + 3H2(g) ![]() 2NH3(g) ΔH = ___________ kJ/mol
2NH3(g) ΔH = ___________ kJ/mol
(2)在恒温恒容体系中进行的合成氨反应,下列能说明该反应已达到平衡状态的是___________
A.容器内N2、H2、NH3的浓度之比为1︰3︰2
B.3v(N2)正=v(H2)逆
C.容器内压强保持不变
D.生成1mol N2的同时消耗2molNH3
(3)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
① 按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数K=_________________(只需代入数据,不用计算结果)
② 按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下,写出电极a的电极反应式:________________________
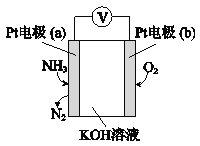
查看答案和解析>>
科目: 来源: 题型:
【题目】埋在地下的输油铸铁管道,在下列各种情况下被腐蚀速度最慢的是
A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中 D. 在含碳粒较多、潮湿透气的土壤中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com