
科目: 来源: 题型:

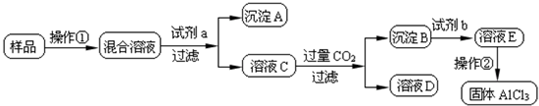
查看答案和解析>>
科目: 来源: 题型:
| c[Cu(NH3)2Ac?CO] |
| c[Cu(NH3)2Ac]×c(CO) |
| c[Cu(NH3)2Ac?CO] |
| c[Cu(NH3)2Ac]×c(CO) |
| 0min | 30min | 45min | 60min | 90min | |
| Cu(NH3)2Ac | 2.0 | 1.2 | 0.9 | 0.9 | 1.8 |
| Cu(NH3)2Ac?CO | 0 | a | 1.1 | 1.1 | 0.2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
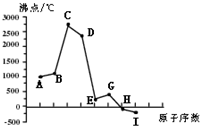 (2012?闸北区一模)同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.
(2012?闸北区一模)同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表.| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com