
科目: 来源: 题型:
【题目】常温下,用0.1000 mol·L-1 HCl溶液滴定20.00 mL 0.100 0 mol·L-1 NH3·H2O溶液,滴定曲线如下图。下列说法不正确的是
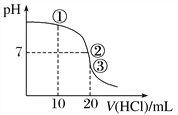
A. ①溶液:c(NH3·H2O)+ c(NH![]() )=2c(Cl-)
)=2c(Cl-)
B. ①溶液:c(NH![]() )+2c(H+)=2c(OH-)+c(NH3·H2O)
)+2c(H+)=2c(OH-)+c(NH3·H2O)
C. ②溶液:c(NH![]() )=c(Cl-)>c(OH-)=c(H+)
)=c(Cl-)>c(OH-)=c(H+)
D. ③溶液:c(NH![]() ) > c(Cl-) > c(H+) > c(OH-)
) > c(Cl-) > c(H+) > c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是______________(用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-)___________(填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)=____________mol/L, c(OH-)- c(HA)=____________mol/L
常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH_________7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH___________7(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图。下列说法不正确的是( )
已知:

①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式改变
查看答案和解析>>
科目: 来源: 题型:
【题目】Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是( )
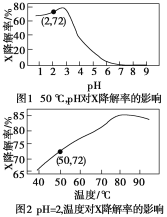
A.50 ℃,pH在3~6时,X降解率随pH增大而减小
B.pH=2,温度在40~80 ℃时,X降解率随温度升高而增大
C.无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80 ℃
D.pH=2,温度为50 ℃时,10 min内X的平均降解速率v(X)=1.44×10-4mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图所示,下列说法正确的是( )
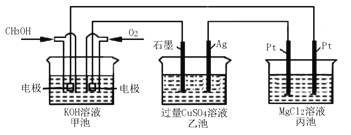
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列微粒能在相应溶液中大量共存的是( )
A.稀硫酸中:K+、MnO4﹣、CH3CH2OH
B.pH=11的溶液中:Na+、CO32﹣、NH3H2O
C.中性溶液中:Na+、NO3﹣、AlO2﹣
D.FeCl3溶液中:H2O2、Mg2+、SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol某烃最多能和2molHCl发生加成反应,生成1mol氯代烷,1mol此氯代烷能和8molCl2发生取代反应,生成只含碳元素和氯元素的氯代烷,该烃可能是( )
A.CH3CH=CH2
B.CH2=CHCH=CH2
C.CH3=CHCH3
D.CH3﹣C≡CH2﹣CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列变化关系,请回答下列问题:(A~E均分别代表一种物质,框图中的部分产物已略去,如A生成D的同时还有CO2生成)
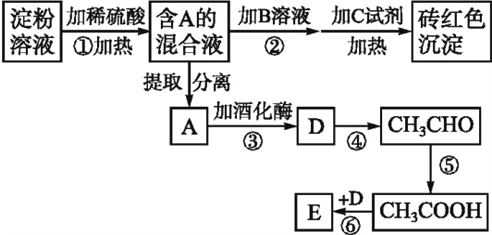
(1)写出A物质的名称____。加B溶液的作用为______________。
(2)写出D的结构简式_________________。
(3)写出下列反应的化学方程式:
③__________________________________。
④__________________________________。
⑥__________________________________。
(4)反应⑥的反应类型是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
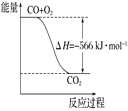
A. CO的标准燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com