
科目: 来源: 题型:
【题目】某气态的烷烃与烯烃的混合气体9 g,其密度为同状况下H2密度的11.2倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为( )
A. 甲烷,乙烯 B. 甲烷,丙烯 C. 乙烷,乙烯 D. 甲烷,丁烯
查看答案和解析>>
科目: 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。
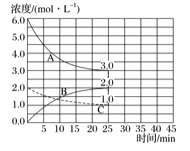
①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. ![]() 比
比![]() 沸点高
沸点高
B. O2-半径比![]() 的小
的小
C. Na和Cs属于第IA族元素,Cs失电子能力比Na的强
D. P和As属于第VA族元素, ![]() 酸性比
酸性比![]() 的弱
的弱
查看答案和解析>>
科目: 来源: 题型:
【题目】将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) ![]() mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
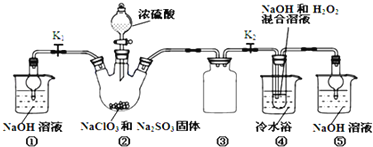
完成下列填空:
(1)装置②中产生ClO2的化学方程式为______.装置③的作用是______.
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②______;③______;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是______;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为________________________________.重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL.该样品中NaClO2的质量分数为______.
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .______(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作中正确的是( )
A. 用规格为10mL的量筒量取6.20mL的液体
B. 称量氢氧化钠固体的质量时,将称量物放在滤纸上,并置于托盘天平的左盘,砝码放在托盘天平的右盘
C. 利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质
D. 用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、W、D、E,Y为短周期元素,且原子序数依次增大,A是周期表中原子半径最小的,B的原子序数为7,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。Y是短周期中原子序数最大的主族元素。
(1)W2-离子的结构示意图为__________,E元素在周期表中的位置为_________,写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式_______________________________。
(2)A2W2的电子式为__________,在酸性条件下A2W2可以将Fe2+氧化成Fe3+,写出该反应的离子方程式__________________________________________。当消耗2mol A2W2时,转移的电子数为____________________。
(3)下列事实能说明Y元素的非金属性比硫(S)元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4) 用电子式表示B的最简单氢化物的形成过程___________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式可能是( )
A. 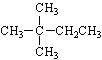 B.
B. ![]()
C. CH3CH2CH2CH2CH3 D. CH3CH2CH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】分别用浓度均为0.5mol/L的NH3·H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是
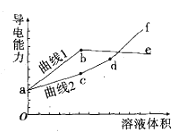
A. 曲线2 代表滴加NH3·H2O溶液的变化曲线
B. b和d点对应的溶液均显碱性
C. b点溶液中c(NH4+)>c(SO42-)>c(H+)>c(OH-)
D. df段导电能力升高的原因是发生了反应Al(OH)3+OH-=[Al(OH)4]-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com