
科目: 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如图所示,下列判断正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>乙
C.最外层电子数:甲>乙
D.最高价氧化物的水化物的碱性:丙>丁>戊
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.硅酸钠的水溶液俗称泡花碱,可用作粘合剂和防火材料
B.碘单质在苯中的溶解度较大,可用苯萃取碘水中的碘单质
C.小苏打可用于配制发酵粉,医疗上也可以用作治疗胃酸过多
D.浓硫酸具有强氧化性,不能干燥二氧化硫气体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.水晶项链和餐桌上的瓷盘都是硅酸盐制品
B.工艺师利用盐酸刻蚀石英制作艺术品
C.二氧化硅可用于制备光导纤维
D.化学家采用玛瑙研砵磨擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
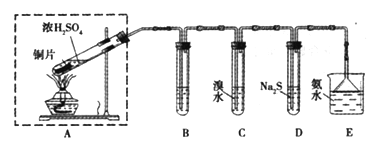
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
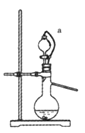
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
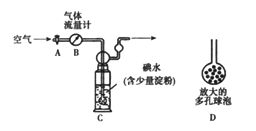
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A(C12H16O2)经碱性水解、酸化后得到B和C(C8H8O2)。C的核磁共振氢谱表明含有苯环,且苯环上有2种氢原子。B经过下列反应后得到环状化合物G,G的实验式为C2H3O,相对分子质量为172,核磁共振氢谱显示只有一个吸收峰。

已知:
请回答下列问题:![]()
(1)写出G的分子式:_______________。
(2)写出A的结构简式:______________________。
(3)写出F→G反应的化学方程式: ____________,该反应属于________(填反应类型)。
(4)C的同分异构体有多种。
①属于芳香族化合物,且能发生水解反应的有_____种;
(5)F可以发生下列变化:
![]()
J的结构简式是_________________,由F可以直接生成H,设计反应①和②的目的是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
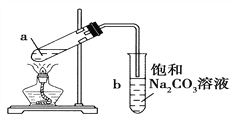
A. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C. 实验时加热试管a的目的是加快反应速率并及时将乙酸乙酯蒸出
D. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】I.电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
(1)请写出FeCl3溶液与铜反应的化学方程式:______________________________________。
检验反应后的溶液中存在Fe3+的试剂常用硫氰化钾溶液,写出反应的离子方程式:_____________________。
II.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
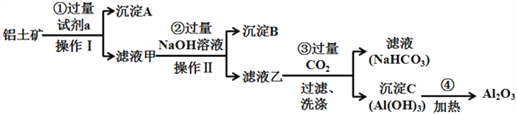
(2)沉淀A的成分是(填化学式)_________。
(3)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(4)步骤③中通入过量CO2气体的离子方程式是______________________;
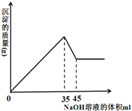
(5)准确称取8g铝土矿样品,加入一定量试剂a的溶液,使其中的Al2O3、Fe2O3恰好溶解;然后,向滤液中加入10mol·L-1的NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,则样品中Al2O3的百分含量为_________。
III.(6)某一反应体系有反应物和生成物共五种物质:O2 、H2CrO4 、Cr(OH)3 、H2O 、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
写出反应的化学方程式_____________________________________________,如反应转移了0.3mol电子,则产生的气体在标准状况下体积为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com