
科目: 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌与CH3COOH溶液反应:Zn+2H+===Zn2++H2↑
B. 氢氧化铝与稀硝酸反应:H++OH-===H2O
C. CuCl2溶液与铁粉反应:3Cu2++2Fe===3Cu+2Fe3+
D. MgCl2溶液与氨水反应:Mg2++2NH3·H2O===Mg(OH)2↓+2NH![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,最终能生成+3价铁的化合物的是( )
①铁粉和稀盐酸②过量铁和稀硝酸③过量铁和FeCl3④氯水和FeCl2⑤FeO和稀硝酸⑥铁粉和足量稀硝酸 ⑦铁片投入CuSO4溶液⑧铁在Cl2中燃烧.
A.②③④⑥
B.④⑤⑥⑧
C.③④⑥⑧
D.②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】欲检验CO2气体中是否含有SO2、HCl,进行如下实验:
①将气体通入酸化的AgNO3溶液中,产生白色沉淀a;
②滤去沉淀a,向滤液中加入Ba(NO3)2溶液,产生白色沉淀b.
下列说法正确的是( )
A.沉淀a为AgCl
B.沉淀b为BaCO3
C.气体中含有SO2
D.气体中没有HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH![]() 与PH
与PH![]() 、CH4、BH
、CH4、BH![]() 、ClO
、ClO![]() 互为等电子体
互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是__________________________。
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
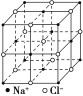
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式为HOOC—CH=CH-CH2OH。
回答下列问题:
(1)请你写出该有机物所含有的官能团的名称:__________________。
(2)验证该有机物中含有-COOH官能团常采用的方法和现象:_____________________。
(3)写出该有机物与溴水反应的化学方程式:_________,反应类型为______。
(4)该有机物可与乙醇发生酯化反应,写出该反应的方程式:____________________,请你写出能增大该反应反应速率的一条措施:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列状态中,可以证明可逆反应N2 + 3H2![]() 2NH3已达平衡状态是
2NH3已达平衡状态是
①一个N≡N键断裂的同时,有3个H—H键断裂
②一个N≡N键断裂的同时,有6个N—H键断裂
③其他条件不变时,体系压强不再改变
④ω(NH3)、ω(N2)和ω(H2)都不再改变
⑤恒温恒容时,密度保持不变
⑥υ正(H2)=0.03 mol·L-1·min-1,υ逆(NH3)=0.02 mol·L-1·min-1
A. 全部 B. ②③④⑥ C. ③④⑤⑥ D. ②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
![]()
![]()
![]()
![]()
![]()
①NH4CuSO3中金属阳离子的核外电子排布式为__________________。N、O、S三种元素的第一电离能大小顺序为____________________(填元素符号)。
②向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是________。
A.氨气极易溶于水,原因之一是NH3分子和H2O分子之间形成氢键的缘故
B.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
C.[Cu(NH3)4]SO4溶液中加入乙醇,会析出深蓝色的晶体
D.已知3.4 g氨气在氧气中完全燃烧生成无污染的气体,并放出a kJ热量,则NH3的燃烧热的热化学方程式为:NH3(g)+3/4O2(g)===1/2N2(g)+3/2H2O(g) ΔH=-5a kJ·mol-1
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的氧气变为臭氧(与SO2互为等电子体)。根据等电子体原理,O3分子的空间构型为________。
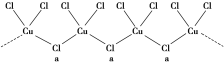
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子(含有一个配位键)的杂化轨道类型为_______________________。
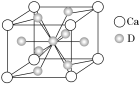
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,已知镧镍合金与上述Ca-D合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第4周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号是________,
该能层具有的原子轨道数为________。
(2)E2+的价层电子排布图是________,
F原子的核外电子排布式是________。
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为________,
B元素的气态氢化物的分子模型为________。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为________。
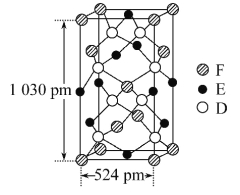
(5)某种化合物由D、E、F三种元素组成,其晶胞如图所示,则其化学式为________,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d=________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗溃、血迹及人体排放的蛋白质、油溃遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
A. ①④ B. ②④ C. ①③ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法中正确的是
A. 汽油、柴油、植物油都是烃的衍生物
B. 米酒变酸的过程涉及了氧化反应
C. 含5个碳原子的有机物分子中最多可形成4个碳碳单键
D. 蛋白质的水解和油脂的皂化都是由高分子生成小分子的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com