
科目: 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.CuSO4溶液和Ba(OH)2溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,不能达到预期目的是:
①苯、浓溴水、溴化铁混合制溴苯 ②苯酚浓溶液与稀溴水反应生成白色沉淀
③用溴水除去混在苯中的己烯,分液得到纯净的苯 ④乙醇和30%的硫酸共热到170℃制乙烯
A. ①②③④ B. ①②③ C. ①②④ D. ②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A.由1-溴丙烷水解制1-丙醇;由乙烯与水反应制乙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷制环己烯;由丙烯与溴制1,2-二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列转化关系中,烃A为石油的裂解气里含是较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:
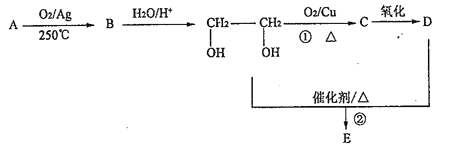
(1)写出A 的结构简式____________。
(2)①的反应类型为___________。
(3)D物质中含氧原子团的名称为___________;写出HOCH2CH2OH与金属钠反应的化学方程式___________。
(4)写出反应②的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
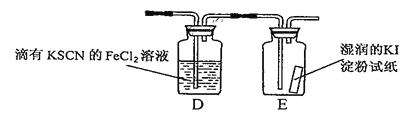
【题目】AlCl3是一种催化剂,某校学习小组用下面装置制备少量AlCl3。已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:

(1)a仪器的名称为_______;A装置中反应的化学方程式为_______。
(2)试剂b为_______;C装置的作用为_______。
(3)所用d导管较粗的原因是_______;E装置的作用为_______。
(4)F装置的作用为_______。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_______;用离子方程式表示E中的现象变化_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】2013年诺贝尔化学奖授予三位美国科学家,以表彰他们如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有________(不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH![]() 呈三角锥形
呈三角锥形
c.NO+电子式为[∶NO∶]+
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极,也可人工合成二价钒(V)固氮酶(结构如图)
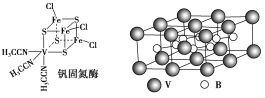
①V2+基态时核外电子排布式为______________________________________。
②钒固氮酶中钒的配位原子有________(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如图所示,该晶胞中含有钒原子数目为________。
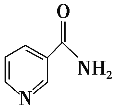
(3)烟酰胺(结构简式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有________,1 mol该分子中含σ键的数目为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2A![]() B+C(吸热反应)分别在以下三种不同条件下进行,B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。
B+C(吸热反应)分别在以下三种不同条件下进行,B、C的初始浓度为O,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表所示,容器容积恒定。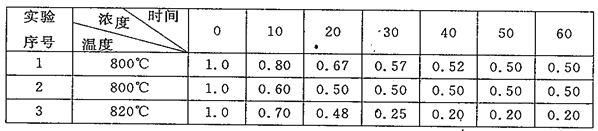
根据上述数据,回答下列问题:
(1)在实验1、2中,实验2可能使用了_____,判断理由是___________。
(2)在实验1、3中,实验3比实验1达到平衡的时问较短,原因是__________。
(3)在实验2、3中,化学反应达到平衡时,实验3中c(A)较小的原因是__________。
(4)在实验2中,10~20min的平均反应速率v(B)=______mol·L-1·min-1。实验3达到平衡时,A的转化率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B的单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
A | 932 | 1 821 | 15 390 | 21 771 |
B | 738 | 1 451 | 7 733 | 10 540 |
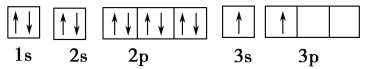
(1)某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背了________。
(2)ACl2分子中A原子的杂化类型为________。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C键的键长大于C60中C—C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确________(填“是”或“否”),并阐述理由______________________________。
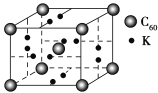
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式______________,该物质的K原子和C60分子的个数比为________。
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是______________________________,NCl3分子的VSEPR模型为________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B. 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C. 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
D. 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为2CaCO3+O2+2SO22CaSO3+2CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液遇石蕊试液显红色,下列各组离子中能在该溶液中大量共存的是( )
A.H+、NO3-、Ca2+、Cl-
B.Cu2+、SO42-、HCO3-、Na+
C.Fe2+、NO3-、OH-、Ba2+
D.MnO4-、SO42-、NO3-、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com