
科目: 来源: 题型:
【题目】下列关于化学反应限度的说法中正确的是
A.改变外界条件不能改变化学反应的限度
B.当某反应在一定条件下达到反应限度时即达到了化学平衡状态
C.当某反应体系中气体的压强不再改变时,该反应一定达到了反应限度
D.当某反应达到限度时,反应物和生成物的浓度一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是硫的重要氧化物,具有特殊的性质。下面是某化学学习小组对二氧化硫性质的验证实验。
(1)实验用品:分液漏斗、__________(玻璃仪器名称)、试管、具支试管、玻璃导管、乳胶管;亚硫酸钠晶体、硫酸(75%~90%)、NaOH稀溶液、NaOH浓溶液、酸性KMnO4溶液、Na2S稀溶液、酚酞试剂。
(2)实验装置
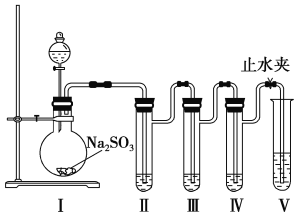
装置图中分液漏斗内的试剂是_________________________。
(3)实验步骤
①按照图示装置连接好实验仪器,检查装置气密性。检查方法是_____________________。
②在具支试管Ⅱ、Ⅲ、Ⅳ中分别加入2 mL NaOH稀溶液(溶液中滴有酚酞试剂)、2 mL酸性KMnO4溶液、2 mL Na2S稀溶液。其中Ⅱ中的实验现象是_____________________________;
Ⅲ中现象说明SO2具有__________性;Ⅳ中若持续通入SO2,写出发生反应的化学方程式:__________________________________。
(4)如果将具支试管Ⅲ内的酸性KMnO4溶液换为氯水,那么具支试管Ⅲ中发生反应的现象是_______________________,发生反应的离子方程式是_________________________。
(5)试管Ⅴ中加入的是NaOH浓溶液,其作用是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应,各物质浓度随时间的变化。若从t。开始,每个时刻只改变一个且不同的条件,物质Z的正、逆反应速率随时间变化如图b。下列说法不正确的是

A. 0~t1min内X与Y的平均速率之比为2:3 B. t2时刻改变的条件可能是压强或催化剂
C. 该反应的正反应为放热反应 D. 该反应中Z一定为产物
查看答案和解析>>
科目: 来源: 题型:
【题目】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g)![]() 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。

(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______,反应放出_____________热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________(填序号)
①SO2的体积分数不再发生变化 ②容器内压强不再发生变化 ③容器内气体原子总数不再发生变化 ④相同时间内消耗2n molSO2的同时生成n molO2 ⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3 ____________(填“增大”“减小”或“不变”)
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________________________________________。
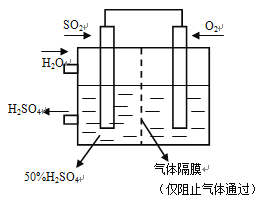
(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是周期表的一部分,X、Y、Z、W、M均为短周期元素,X、Z的质子数之和是20。下列说法不正确的是
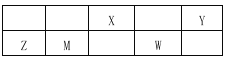
A. X是动植物生长不可缺少的元素,是蛋白质的重要组成元素
B. Z的最高价氧化物的水化物是两性氢氧化物,能溶于氨水
C. 气态氢化物的稳定性Y>W>M
D. M的最高价氧化物可用于光导纤维
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A.硫酸、纯碱、碳酸氢钠和生石灰分别属于酸、碱、盐和氧化物
B.用丁达尔效应区别FeCl3溶液和Fe(OH)3胶体
C.生石灰与水混合的过程只发生物理变化
D.H2O、CH3COOH、Cu(NH3)4SO4均含有氧,都是氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的反应一定是吸热反应
B. 同温同压下,H2 (g) +Cl2(g) =2HCl (g)在光照和点燃条件下的△H不同
C. 保持其它条件不变,增加反应物的量或增大压强,反应速率就会随之改变
D. 使用催化剂会加快反应速率是因为催化剂降低了反应物的活化能
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有18个电子,相关信息如下表所示(“/”表示相应的信息略去):
化合物 | X | Y | Z |
分子中含有的原子个数 | / | 4 | / |
摩尔质量/g·mol-1 | 32 | 34 | / |
回答下列问题:
(1)X常用作火箭推进剂,其分子的球棍模型为![]() 则X的化学式为________。
则X的化学式为________。
(2)Y的化学性质描述正确的是________。
a.不稳定性 b.弱碱性
c.氧化性 d.还原性
(3)Z的化学式可用H2A表示。将一定量的Z气体通入0.05 mol·L-1CuSO4溶液中,二者恰好完全反应。已知Ksp(CuA)=6.0×10-36。若不考虑溶液体积的变化,则:
①反应后溶液的pH=________。
②若反应后溶液中c(A2-)=2.0×10-30mol·L-1,则溶液中c(Cu2+)=________mol·L-1。
(4)将一定量的Z气体通入NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。
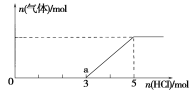
①0点溶液中所含溶质的化学式为____________。
②已知a点溶液呈碱性,该溶液中离子浓度大小顺序为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾。
(1)SO2和O2反应制取SO3的反应原理为2SO2(g)+O2(g) ![]() 2SO3(g),在一密闭容器中一定时间内达到平衡。
2SO3(g),在一密闭容器中一定时间内达到平衡。
①该反应的平衡常数表达式为K=________。
②该反应达到平衡状态的标志是________。
A.v(SO2)=v(SO3)
B.混合物的平均相对分子质量不变
C.混合气体质量不变
D.各组分的体积分数不变
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

① B电极的电极反应式_______________________________________。
②溶液中H+的移动方向由________极到________极(用A、B表示);
(3)测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式)。
________Fe2++________MnO![]() +________===________Fe3++________Mn2++________
+________===________Fe3++________Mn2++________
② 用硫酸酸化的KMnO4滴定终点的标志是
___________________________________
___________________________________。
③计算上述产品中FeSO4·7H2O的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】
锂离子电池的广泛应用使得锂电池的回收利用一直是科学家关注的焦点。磷酸铁锂是锂电池中最有前景的正极材料,磷酸铁是其前驱体,充放电时可以实现相互转化。某研究性小组对废旧锂离子电池正极材料(图中简称废料,成份为LiFePO4、碳粉和铝箔)进行金属资源回收研究,设计实验流程如下:
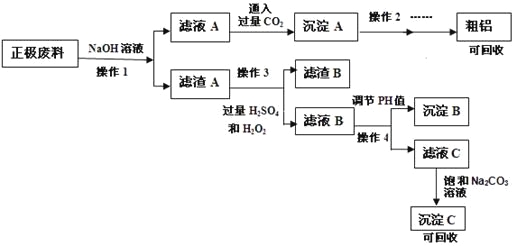
已知:① FePO4可溶于稀H2SO4,不溶于水和其他的酸。
② Li2SO4、LiOH和Li2CO3在273K下的溶解度分别为34.2g、22.7g和1.54g,
在373K下,Li2CO3的溶解度为0.72g
③ Ksp[Al(OH)3]=10-32 Ksp[Fe(OH)3]=4×10-38
(1)操作1为: 。
(2)滤液A中通入过量CO2的化学方程式为: 。
(3)可以提高操作1浸出率的方法有(写出3种) 。
(4)完成操作3中的离子方程式: 。
(5)该锂电池充电时的阳极反应式: 。
(6)操作4中应选择试剂: 。
(7)沉淀C的成分: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com