
科目: 来源: 题型:
【题目】H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
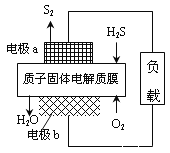
A. 电池工作时,电流从电极a经负载流向电极b
B. 电极a上发生的电极反应为:2H2S - 4e-=S2 + 4H+
C. 当反应生成64gS2时,电池内部释放632kJ热能
D. 当电路中通过4mol电子时,有4molH+经质子膜进入负极区
查看答案和解析>>
科目: 来源: 题型:
【题目】向甲、乙两个容积均为1L的恒容容器中分别充入2 mol
A. 2 molB和1 molA、l mol B。相同条件下发生如下反应:A(g)+B(g)![]() xC(g) H<0。测得两容器中
xC(g) H<0。测得两容器中![]() 随时间t的变化如图所示。下列说法错误的是 ( )
随时间t的变化如图所示。下列说法错误的是 ( )
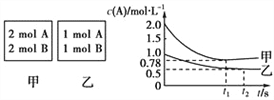
A.x可能等于2也可能等于3
B. 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数减小
C. 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同
D. 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25molL-1<c(A)<0.5molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】进入秋季平坝有时也出现大雾天气,致使汽车行驶缓慢,下列关于雾的说法正确的是
A.雾中水滴的直径小于1nm B.雾中水滴的直径在1nm~100nm之间
C.不会产生丁达尔现象 D.无法确定雾中水滴的直径大小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是( )
A.CaCl2=Ca2++Cl2
B.Na2SO4=Na++SO42﹣
C.HNO3=H++NO3﹣
D.KOH=K++O2﹣+H+
查看答案和解析>>
科目: 来源: 题型:
【题目】铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为_______________________。
(2)以H2、O2、熔融Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2。
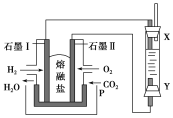
①石墨Ⅰ电极上的电极反应式为________________________________。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是________(填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作电解液
C.阴极发生的反应是2H2O+2e-===H2↑+2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为______________________________,该反应的化学方程式为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
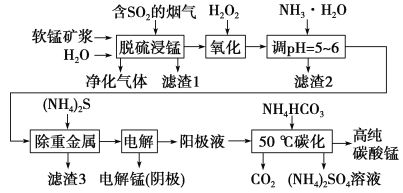
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为_______________________。
(2)“滤渣2”中主要成分的化学式为______________。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是______________________。
(4)“电解”时用惰性电极,阳极的电极反应式为_______________________________。
(5)“50 ℃碳化”得到高纯碳酸锰,反应的离子方程式为____________________________。“50 ℃碳化”时加入过量NH4HCO3,可能的原因:使MnSO4充分转化为MnCO3;________________;________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
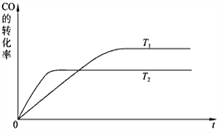
① 该反应的焓变ΔH____________0(填“<”、“>”或“=”)。② T1和T2温度下的平衡常数大小关系是K1____________K2(填“<”、“>”或“=”)。③ 若容器容积不变,下列措施可增加甲醇产率的是______________。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①平衡常数K=________________。
②若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时V正______V逆(填“<”、“>”或“=”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。
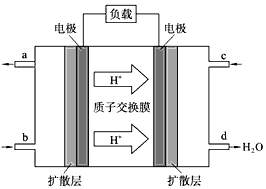
① 该电池工作时,b口通入的物质为____________。
② 该电池正极的电极反应式为 ___________________。
③ 工作一段时间后,当3.2g甲醇完全反应生成CO2时,有___________NA个电子转移。
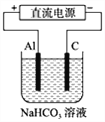
(4)以上述电池做电源,用下图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。
请回答下列问题:
(1)戊离子的结构示意图为________。
(2)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
(3)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:__________________。
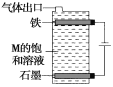
(4)按如图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:____________________________。将充分电解后所得溶液逐滴加入酚酞溶液中,观察到的现象是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机实验操作或叙述正确的是( )
A.将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色
B.甲烷和氯气在室温下的黑暗环境中可以稳定存在
C.苯能使溴水退色是因为二者反应生成了溴苯
D.要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com